Nome Comercial/ Apresentação
Cosentyx (secuquinumabe) 150 mg/mL / Solução injetável
Classe Terapêutica
Inibidores da interleucina
Indicação
Psoríase em placas
Cosentyx® é indicado para o tratamento de psoríase em placas moderada a grave em pacientes com 6 anos de idade ou mais que são candidatos a terapia sistêmica ou fototerapia.
Artrite psoriásica
Cosentyx® é indicado para o tratamento de artrite psoriásica ativa em pacientes adultos, quando a resposta à terapia prévia com medicamentos antirreumáticos modificadores do curso da doença (DMARDs) for inadequada. Cosentyx® pode ser utilizado isoladamente ou em combinação com metotrexato.
Espondiloartrite axial (EpA axial) com ou sem dano radiográfico
• Espondilite anquilosante (EA) / EpA axial com dano radiográfico
Cosentyx® é indicado para o tratamento de espondilite anquilosante ativa em pacientes adultos, que não tenham respondido adequadamente à terapia convencional.
• Espondiloartrite axial não radiográfica (EpAax-nr) / EpA axial sem dano radiográfico
Cosentyx® é indicado para o tratamento de espondiloartrite axial não radiográfica ativa com sinais objetivos de inflamação, como indicado por proteína C reativa (PCR) elevada e/ou evidência na ressonância magnética (RM) em adultos que responderam de maneira inadequada a anti-inflamatórios não esteroidais (AINEs).
Artrite Idiopática Juvenil (AIJ)
• Artrite Relacionada à Entesite (ARE)
Cosentyx® é indicado para o tratamento de artrite relacionada à entesite ativa em pacientes acima de 4 anos de idade.
• Artrite Psoriásica Juvenil (APJ)
Cosentyx® é indicado para o tratamento da artrite psoriásica juvenil ativa em pacientes acima de 2 anos de idade.
Hidradenite Supurativa (HS)
Cosentyx® é indicado para o tratamento de hidradenite supurativa (acne inversa) moderada a grave ativa em pacientes adultos com resposta inadequada à terapia convencional sistêmica.
Dose
– Psoríase em placas
Pacientes adultos
A dose recomendada é de 300mg por injeção subcutânea, com administração inicial nas semanas 0, 1, 2, 3 e 4, seguida por administração de manutenção mensal. Alguns pacientes com peso corporal igual ou superior a 90kg podem obter um benefício adicional ao receber 300mg a cada 2 semanas. Cada dose de 300mg é administrada na forma de uma injeção subcutânea de 300mg ou duas injeções subcutâneas de 150mg.
Pacientes pediátricos
A dose recomendada é baseada no peso corporal (Tabela 16) e administrada por injeção subcutânea com administração inicial nas semanas 0, 1, 2, 3 e 4, seguida por administração de manutenção mensal (a cada 4 semanas). Cada dose de 75 mg é administrada como uma injeção subcutânea de 75mg. Cada dose de 150mg é administrada como uma injeção subcutânea de 150mg. Cada dose de 300mg é administrada em uma injeção subcutânea de 300mg ou duas injeções subcutâneas de 150mg.
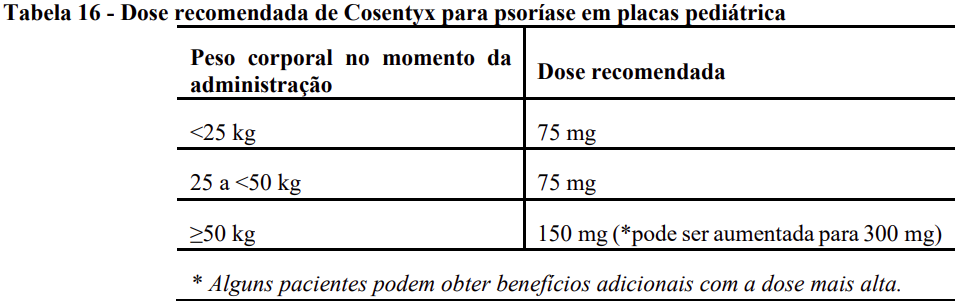
– Artrite psoriásica
Para pacientes com psoríase em placas moderada a grave concomitante, ou que são respondedores inadequados a anti‐TNFα, a dose recomendada é de 300mg, com dose inicial nas Semanas 0, 1, 2, 3 e 4, seguida de dose mensal de manutenção. Cada dose de 300mg é administrada em uma injeção subcutânea de 300mg ou duas injeções subcutâneas de 150mg. Para outros pacientes, a dose recomendada é de 150mg por injeção subcutânea, com dose inicial nas Semanas 0, 1, 2, 3 e 4, seguida de dose mensal de manutenção. Com base na resposta clínica, a dose pode ser aumentada para 300mg.
– Espondiloartrite axial (EpA axial)
Espondilite anquilosante (EA)
A dose recomendada é de 150mg, administrada por injeção subcutânea, com dose inicial nas semanas 0, 1, 2, 3 e 4, seguida de dose mensal de manutenção. Com base na resposta clínica, a dose pode ser aumentada para 300mg. Cada dose de 300mg é administrada em uma injeção subcutânea de 300mg ou duas injeções subcutâneas de 150mg.
Espondiloartrite axial não radiográfica (EpAax-nr)
A dose recomendada é de 150mg, administrada por injeção subcutânea, com administração inicial nas semanas 0, 1, 2, 3 e 4, seguida por administração de manutenção mensal.
Artrite Idiopática Juvenil (AIJ), Artrite Relacionada a Entesite (ARE) e Artrite Psoriásica Juvenil (APJ) A dose recomendada é baseada no peso corporal. Para pacientes com peso <50kg, a dose é de 75mg. Para pacientes com peso ≥ 50Kg, a dose é de 150mg. Cosentyx® é administrado por injeção subcutânea nas Semanas 0, 1, 2, 3 e 4, seguido por dosagem de manutenção mensal (a cada 4 semanas). Cada dose de 75mg é administrada como uma injeção subcutânea de 75mg. Cada dose de 150mg é administrada como uma injeção subcutânea de 150mg.
Hidradenite Supurativa (HS)
A dose recomendada é de 300mg por injeção subcutânea, com administração inicial nas Semanas 0, 1, 2, 3, e 4, seguida por administração de manutenção mensal. Baseado na resposta clínica, a dose de manutenção pode ser aumentada para 300mg a cada 2 semanas. Cada dose de 300mg é administrada na forma de uma injeção subcutânea de 300 mg ou duas injeções subcutâneas de 150mg. Para todas as indicações acima descritas, os dados disponíveis sugerem que uma resposta clínica é usualmente atingida dentro de 16 semanas de tratamento. Alguns pacientes com resposta parcial inicial podem melhorar posteriormente com a continuação do tratamento para além das 16 semanas. A continuação do tratamento deve ser cuidadosamente considerada pelo médico, com base na resposta clínica do paciente.
Ajuste de dose
Insuficiência renal: não há ajustes de dosagem previstos na bula do fabricante.
Insuficiência hepática: não há ajustes de dosagem previstos na bula do fabricante.
Preparo
A caixa contém seringa preenchida selada individualmente em um blister de plástico.
Vias de administração
SUBCUTÂNEA
Administração
É administrado por meio de injeção subcutânea. Se possível, deve-se evitar como locais de injeção as áreas da pele que apresentam psoríase. Após o treinamento adequado em técnica de injeção subcutânea, os pacientes ou cuidadores poderão realizar a autoaplicação da injeção, caso um médico determine que isso seja apropriado.
No entanto, o médico deverá garantir o acompanhamento adequado dos pacientes. Pacientes e cuidadores devem ser orientados a injetar a quantidade total, de acordo com as instruções fornecidas na bula. Para pacientes recebendo a dose de 75mg, a seringa preenchida de 75mg / 0,5mL deve ser usada.
Cuidados específicos e monitoramento
Indivíduos sensíveis ao látex
A tampa removível da caneta contém látex de borracha natural que pode causar uma reação alérgica em indivíduos sensíveis ao látex. O uso seguro da caneta preenchida em indivíduos sensíveis ao látex não foi estudado.
Vacinações
Vacinas de vírus vivos não devem ser administradas concomitantemente. Os pacientes tratados podem receber concomitantemente vacinas inativadas ou não vivas. Em um estudo, após a administração de vacinas meningocócicas e de influenza inativada, voluntários saudáveis tratados com 150mg de secuquinumabe e tratados com placebo apresentaram uma resposta imunológica adequada em uma proporção semelhante, correspondendo a um aumento mínimo de 4 vezes nos títulos de anticorpos contra vacinas meningocócicas e de influenza. Os dados sugerem que não compromete a resposta imunológica humoral a vacinas meningocócicas ou de influenza. Antes de iniciar o tratamento é recomendado que pacientes pediátricos recebam todas as imunizações apropriadas para sua idade, de acordo com os guias de imunização vigentes.
Gravidez e lactação
– Gravidez
Não há dados adequados sobre o uso em mulheres grávidas. Estudos em animais não indicam efeitos prejudiciais diretos ou indiretos com relação à gravidez, desenvolvimento embriofetal, parto ou desenvolvimento pós-natal. Uma vez que estudos de reprodução em animais nem sempre são indicativos da resposta em humanos, apenas deve ser usado durante a gravidez se os benefícios evidentemente superarem os riscos potenciais. Enquadra-se na categoria B de risco na gravidez. Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica ou do cirurgião-dentista.
– Lactação
Não se sabe se o secuquinumabe é excretado no leite humano. Considerando que as imunoglobulinas são excretadas no leite humano, deve-se ter cautela ao administrar em mulheres que estejam amamentando.
Homens e mulheres com potencial reprodutivo
– Infertilidade
Não existem recomendações especiais para mulheres com potencial para engravidar. O efeito sobre a fertilidade em humanos não foi avaliado. Não foram observados efeitos indesejáveis de anticorpos anti-IL-17A murino em estudos de fertilidade e desenvolvimento embrionário inicial em camundongos. A alta dose usada no estudo foi superior à dose máxima eficaz em termos de supressão e atividade de IL-17A.
Interações medicamentosas
Vacinas de vírus vivos não devem ser administradas concomitantemente. Em um estudo em indivíduos adultos com psoríase em placas, não foi observada interações entre secuquinumabe e midazolam. Foi administrado concomitantemente com metotrexato (MTX) e/ou corticosteroides em estudos de espondiloartrites (incluindo AP e EpA axial), nos quais não se observou interação.
Estabilidade/ Conservação
Deve ser armazenado sob refrigeração (entre 2ºC e 8ºC), proteger da luz e não congelar. Se necessário, poder ser mantido fora da geladeira por um curto período de até 4 dias em temperatura ambiente, não acima de 30°C.
Reações adversas
Reações Adversas na Psoríase em Placa
Pacientes adultos
As reações adversas ao medicamento relatadas mais frequentemente foram infecções do trato respiratório superior (mais frequentemente nasofaringite, rinite). A maioria dessas reações foi de intensidade leve ou moderada.
Pacientes pediátricos
O perfil de segurança relatado foi consistente com o perfil de segurança relatado em pacientes adultos com psoríase em placas.
Reações adversas de relatos espontâneos e casos de literatura (frequência desconhecida)
As seguintes reações adversas foram relatadas da experiência pós-comercialização através de relatos de casos espontâneos e casos de literatura. Por conta de essas reações serem voluntariamente relatadas de uma população de tamanho incerto, não é possível estimar de forma confiável a sua frequência que é, portanto, categorizada como desconhecida. As reações adversas aos medicamentos estão listadas de acordo com a classe de sistema de órgãos no MedDRA. Dentro de cada classe de sistema de órgão, RAMs são apresentadas em ordem decrescente de gravidade.
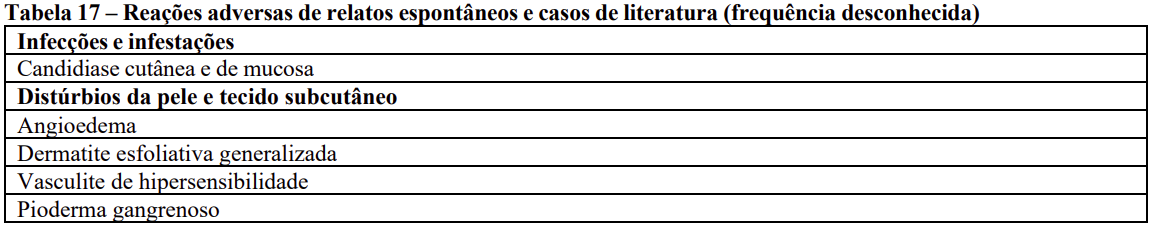
Lista tabelada de reações adversas
As reações adversas ao medicamento provenientes de estudos clínicos (Tabela 18) estão relacionadas de acordo com a classe de sistema orgânico do MedDRA. Dentro de cada classe de sistema de órgãos, as reações adversas ao medicamento são classificadas pela frequência, com as reações mais frequentes aparecendo primeiro. Dentro de cada agrupamento de frequência, as reações adversas ao medicamento são apresentadas em ordem de gravidade decrescente. Além disso, a categoria de frequência correspondente para cada reação adversa ao medicamento tem como base a convenção a seguir (CIOMS III): muito comum (≥ 1/10); comum (≥ 1/100 a < 1/10); incomum (≥ 1/1.000 a < 1/100); rara (≥ 1/10.000 a < 1/1.000); muito rara (< 1/10.000).
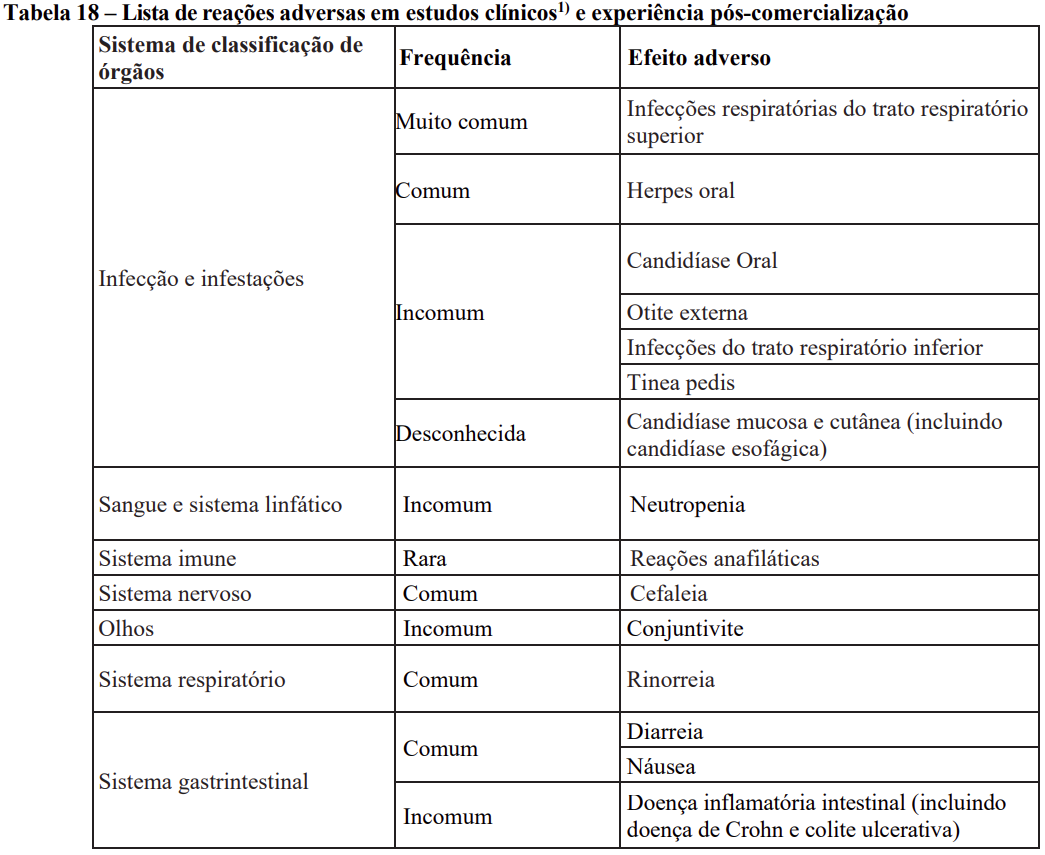
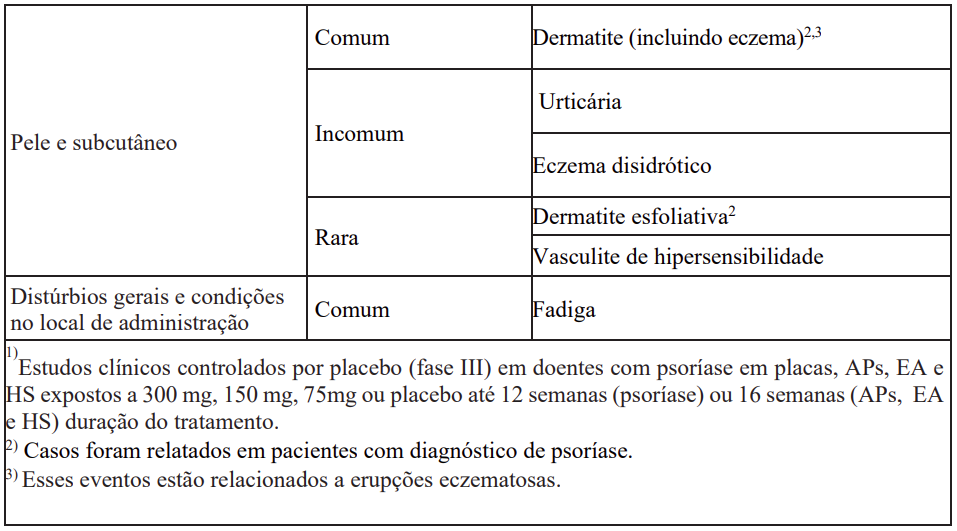
Contraindicações
Reações graves de hipersensibilidade ao princípio ativo ou a qualquer um dos excipientes.
Fonte:
Cosentyx®. [Bula]. São Paulo: Novartis Biociências S.A. Disponível em: https://consultas.anvisa.gov.br/#/bulario/q/?numeroRegistro=100681122: 28/08/2025
