Nome Comercial/ Apresentação
Vivaxxia (rituximabe) 10mg/mL / Solução para diluição para infusão 10mL
Vivaxxia (rituximabe) 10mg/mL / Solução para diluição para infusão 50mL
Classe Terapêutica
Anticorpo monoclonal
Indicação
Linfoma não Hodgkin
– Pacientes adultos com linfoma não Hodgkin de células B, baixo grau ou folicular, CD20 positivo, recidivado ou resistente à quimioterapia;
– Pacientes adultos com linfoma não Hodgkin difuso de grandes células B, CD20 positivo, em combinação à quimioterapia CHOP;
– Pacientes adultos com linfoma não Hodgkin de células B, folicular, CD20 positivo, não tratados previamente, em combinação com quimioterapia;
– Pacientes adultos com linfoma folicular, como tratamento de manutenção, após resposta à terapia de indução.
Leucemia linfoide crônica
Em combinação com quimioterapia é indicado para o tratamento de pacientes com leucemia linfoide crônica (LLC) não tratados previamente e com recaída/refratária ao tratamento.
Dose
Tratamento inicial
– Monoterapia
A dosagem recomendada como monoterapia para pacientes adultos é de 375mg/m2 de superfície corpórea, administrada como infusão intravenosa, uma vez por semana, por quatro semanas.
– Terapia combinada
A dosagem recomendada quando associado à quimioterapia é de 375mg/m2 de superfície corpórea por ciclo para um total de:
– Oito ciclos de R-IV com CVP (21 dias/ciclo);
– Oito ciclos de R-IV com MCP (28 dias/ciclo);
– Oito ciclos de R-IV com CHOP (21 dias/ciclo); seis ciclos se a remissão completa for alcançada após quatro ciclos;
– Seis ciclos de R-IV com CHVP – interferona (21 dias/ciclo).
Deve ser administrado no dia 1 de cada ciclo de quimioterapia, após administração IV do componente glicocorticoide da quimioterapia, se pertinente.
Retratamento após recidiva
Pacientes que tenham respondido inicialmente a Vivaxxia® poderão ser tratados novamente na dose de 375mg/m2 de superfície corpórea, administrado por infusão intravenosa, uma vez por semana, por quatro semanas.
Tratamento de manutenção
Após resposta à terapia de indução, os pacientes não tratados previamente podem receber terapia de manutenção na dose de 375mg/m2 de superfície corpórea, uma vez a cada dois meses até a progressão da doença ou por período máximo de dois anos (12 infusões no total). Após resposta à terapia de indução, os pacientes com recaída/refratários podem receber terapia de manutenção na dose de 375mg/m2 de superfície corpórea, uma vez a cada três meses, até a progressão da doença ou por período máximo de dois anos (8 infusões no total).
Linfoma não Hodgkin difuso de grandes células B em adultos
Em pacientes com Linfoma não Hodgkin difuso de grandes células B, deve ser usado em combinação com o esquema quimioterápico CHOP (ciclofosfamida, doxorrubicina, prednisona e vincristina). A dose recomendada é de 375mg/m2 de superfície corpórea, administrado no dia 1 de cada ciclo da quimioterapia, por oito ciclos. O componente glicocorticoide prednisona do esquema CHOP deve ser administrado no dia 1 antes da administração, e os outros componentes do esquema CHOP devem ser administrados após a administração de Vivaxxia®.
Leucemia linfoide crônica
A dosagem recomendada em combinação com quimioterapia a pacientes com LLC recaída/refratária e previamente não tratados é 375mg/m2 por área de superfície corporal administrada no primeiro dia do primeiro ciclo do tratamento, seguida por 500mg/m2 por área de superfície corporal administrada no primeiro dia de cada ciclo subsequente por seis ciclos ao total. A quimioterapia deve ser dada após infusão de Vivaxxia®.
Uso pediátrico
A segurança e a eficácia em pacientes pediátricos (de ≥ 2 até < 18 anos de idade) não foram estabelecidas.
Uso geriátrico
Não é necessário ajuste de dose para pacientes idosos (≥ 65 anos de idade).
Pacientes obesos
Pacientes obesos devem ter sua dose calculada com base na sua área de superfície corpórea, e nenhum ajuste de dose adicional é necessário nessa população.
Ajuste de dose
Insuficiência renal: não há ajustes de dosagem previstos na bula do fabricante.
Insuficiência hepática: não há ajustes de dosagem previstos na bula do fabricante.
Preparo
Utilize agulha e seringa estéreis para o preparo. Retirar a quantidade necessária sob condições de assepsia e diluir para uma concentração calculada de 1 – 4mg/mL em bolsa de infusão com solução estéril, não pirogênica de soro fisiológico a 0,9% ou de soro glicosado a 5%. Para misturar a solução, inverta a bolsa delicadamente, para evitar a formação de espuma.
Medicações parenterais devem ser inspecionadas visualmente quanto à existência de partículas em suspensão ou alteração da cor antes da administração.
A solução pronta para infusão é física e quimicamente estável por 24 horas, entre 2 °C e 8 ºC, e, subsequentemente, por até 12 horas em temperatura ambiente.
Vias de administração
INTRAVENOSA
Administração
Deve ser administrado por infusão intravenosa (IV) por meio de acesso exclusivo, em local com recursos disponíveis para ressuscitação e sob estrita supervisão de um médico experiente. Não administrar por via subcutânea ou como injeção intravenosa ou em bolus.
Instruções gerais
É importante checar a rotulagem do medicamento para assegurar que a formulação intravenosa e a concentração apropriada estão sendo dadas ao paciente, conforme prescrito.
Pré-medicação e medicamentos profiláticos
Pré-medicação, consistindo de analgésico/antipirético (por exemplo, paracetamol) e anti-histamínico (por exemplo, difenidramina), deverá ser sempre administrada antes de cada infusão.
Em pacientes com linfoma não Hodgkin e leucemia linfoide crônica, pré-medicação com glicocorticoide também deve ser administrada, especialmente se não estiver sendo administrado em associação com quimioterapia que contenha esteroide.
Profilaxia com hidratação adequada e administração de uricostáticos, iniciando 48 horas antes do início da terapia, é recomendada a pacientes com LLC para reduzir o risco de síndrome de lise tumoral. Para pacientes com LLC cuja contagem de linfócitos é > 25×109/L, é recomendado administrar prednisona / prednisolona 100mg IV dentro de 30 minutos antes de cada infusão, para diminuir a velocidade e a gravidade das reações agudas de infusão e/ou síndrome de liberação de citocinas.
Ajuste de dosagem durante o tratamento: não são recomendadas reduções de dose. Quando administrado em combinação com o esquema quimioterápico, devem ser aplicadas reduções de dose padrão para as drogas quimioterápicas.
Velocidade de infusão
Primeira infusão: A velocidade inicial recomendada para a primeira infusão é de 50mg/h. Posteriormente, essa velocidade poderá ser aumentada em 50mg/h, a cada 30 minutos, até o máximo de 400mg/h.
Infusões subsequentes: As infusões subsequentes poderão ser iniciadas a uma velocidade de 100mg/h, com incrementos de 100mg/h, a cada 30 minutos, até o máximo de 400mg/h.
Cuidados específicos e monitoramento
Rastreabilidade
Para aumentar a rastreabilidade dos medicamentos biológicos, o nome comercial e o número de lote do produto administrado devem ser claramente registrados (ou declarados) no prontuário médico do paciente.
Vivaxxia® 100mg/10mL: Este medicamento contém 2,3 mmol (ou 52,6mg) de sódio em cada frasco de 10mL, o que deve ser considerado quando utilizado por pacientes hipertensos ou em dieta de restrição de sódio.
Vivaxxia® 500mg/50mL: Este medicamento contém 11,5 mmol (ou 263,2mg) de sódio em cada frasco de 50mL, o que deve ser considerado quando utilizado por pacientes hipertensos ou em dieta de restrição de sódio.
Teste sorológico falso-negativo para infecções
Devido ao risco de teste sorológico falso-negativo para infecções, ferramentas alternativas de diagnóstico devem ser consideradas em caso de pacientes que apresentam sintomas indicativos de doenças infecciosas raras como, por exemplo, Vírus do Nilo Ocidental e neuroborreliose.
Imunizações
A segurança da imunização com vacinas virais vivas após a terapia com rituximabe não foi estudada em pacientes com LNH e LLC e não se recomenda a vacinação com vacinas com vírus vivos. Os pacientes podem receber vacinas não vivas, no entanto, as taxas de resposta com vacinas não vivas podem ser reduzidas. Em um estudo não randomizado, pacientes com recidiva de LNH de baixo grau que receberam MabThera® em monoterapia comparados com controles saudáveis não tratados apresentaram uma taxa menor de resposta à vacinação com memória do antígeno de tétano e neoantígeno Keyhole Limpet Haemocyanin (KLH). Presumem-se resultados semelhantes para pacientes com LLC, considerando-se as semelhanças entre ambas as doenças, mas isso ainda não foi estudado em estudos clínicos.
Os níveis médios pré-terapêuticos de anticorpos contra um painel de antígenos (Streptococcus pneumoniae, Influenza A, caxumba, rubéola, catapora) foram mantidos por pelo menos 6 meses após o tratamento.
Reações cutâneas
Foram relatadas reações cutâneas graves, como necrólise epidérmica tóxica (síndrome de Lyell) e síndrome de Stevens-Johnson, algumas com resultados fatais. Caso um desses eventos ocorra, com suspeita de relação com Vivaxxia®, o tratamento deverá ser descontinuado permanentemente.
Toxicidade renal
Toxicidade renal severa, incluindo fatal, pode ocorrer em pacientes com LNH. Toxicidade renal ocorreu em pacientes com síndrome da lise tumoral e em pacientes com LNH sob administração de terapia concomitante com cisplatina durante estudos clínicos. A combinação com cisplatina não é um regime de tratamento aprovado. Sinais de falência renal devem ser monitorados atentamente e o tratamento deve ser descontinuado em pacientes que apresentem aumento na creatinina sérica ou oligúria.
– Fertilidade, gravidez e lactação
Contracepção em homens e mulheres
Devido ao longo período de retenção do rituximabe em pacientes com depleção de células B, mulheres com potencial para engravidar deverão utilizar métodos contraceptivos eficazes durante o tratamento e por 12 meses após seu fim.
Gravidez
Categoria de risco na gravidez: C.
Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica ou do cirurgião-dentista.
Sabe-se que as imunoglobulinas IgG cruzam a barreira placentária.
Os níveis de células B em recém-nascidos humanos após a exposição materna não foram estudados em estudos clínicos. Não há dados adequados e bem controlados provenientes de estudos em mulheres grávidas. No entanto, foram relatadas depleção temporária de células B e linfocitopenia em alguns recém-nascidos filhos de mães expostas a rituximabe durante a gravidez. Foram observados efeitos semelhantes em estudos com animais. Por esses motivos, não deverá ser administrado a mulheres grávidas, a menos que o possível benefício supere os potenciais riscos.
Fertilidade
Estudos em animais não revelaram efeitos prejudiciais de rituximabe nos órgãos reprodutores.
– Pacientes idosos
Os dados sugerem que a disponibilidade não se altera em função da idade. Nos estudos clínicos, os pacientes idosos não receberam doses reduzidas.
– Uso pediátrico
A segurança e a eficácia em pacientes pediátricos ainda não foram estabelecidas. Embora não esteja aprovado para uso pediátrico, hipogamaglobulinemia, em alguns casos grave, tem sido observada em pacientes pediátricos que fizeram uso do medicamento, exigindo a administração de imunoglobulina em longo prazo como terapia de substituição.
As consequências da depleção de células B em longo prazo em pacientes pediátricos são desconhecidas.
– Efeitos sobre a capacidade de dirigir veículos ou operar máquinas
Não foram realizados estudos sobre os efeitos na habilidade de dirigir veículos ou operar máquinas, porém, a atividade farmacológica e as reações adversas relatadas até o momento não indicam que esses efeitos devam ser esperados.
Até o momento, não há informações de que Vivaxxia® possa causar doping.
Interações medicamentosas
Os dados sobre possíveis interações medicamentosas são limitados até o momento.
Em pacientes com LLC, a coadministração com rituximabe não mostrou ter efeito na farmacocinética de fludarabina ou ciclofosfamida. Além disso, não houve efeito aparente de fludarabina e ciclofosfamida sobre a farmacocinética do rituximabe.
Não interage com alimentos. Pacientes que desenvolvem anticorpos humanos anticamundongo (HAMA) ou anticorpo antidroga (ADA) poderão desenvolver reações alérgicas ou de hipersensibilidade quando utilizarem outros anticorpos monoclonais.
Estabilidade/ Conservação
Deve ser armazenado em geladeira (de 2 ºC a 8 ºC). Manter os frascos dentro do cartucho para proteger da luz.
Após preparo, a solução pronta para infusão é física e quimicamente estável por 24 horas, entre 2°C e 8°C, e, subsequentemente, por até 12 horas em temperatura ambiente. Do ponto de vista microbiológico, a solução pronta para infusão deve ser usada imediatamente. Caso não seja usada imediatamente, o prazo de armazenamento e as condições pré-utilização são de responsabilidade do usuário e não devem ultrapassar 24 horas entre 2°C e 8°C e, subsequentemente, por até 12 horas em temperatura ambiente.
Reações adversas
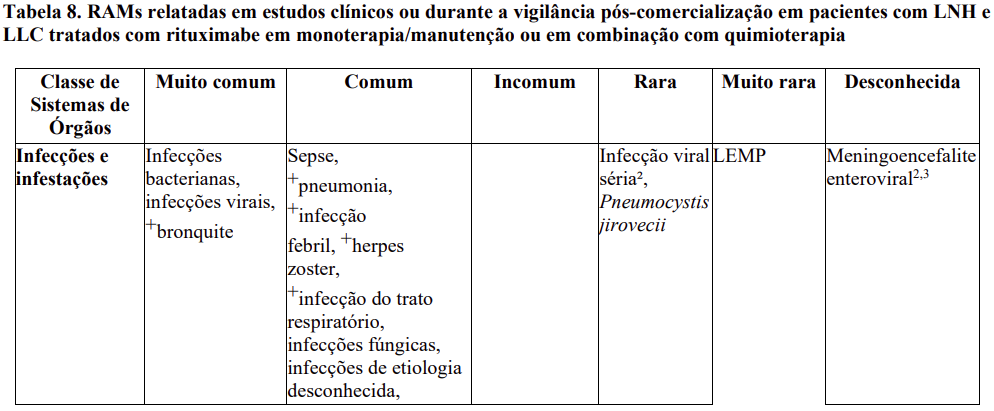
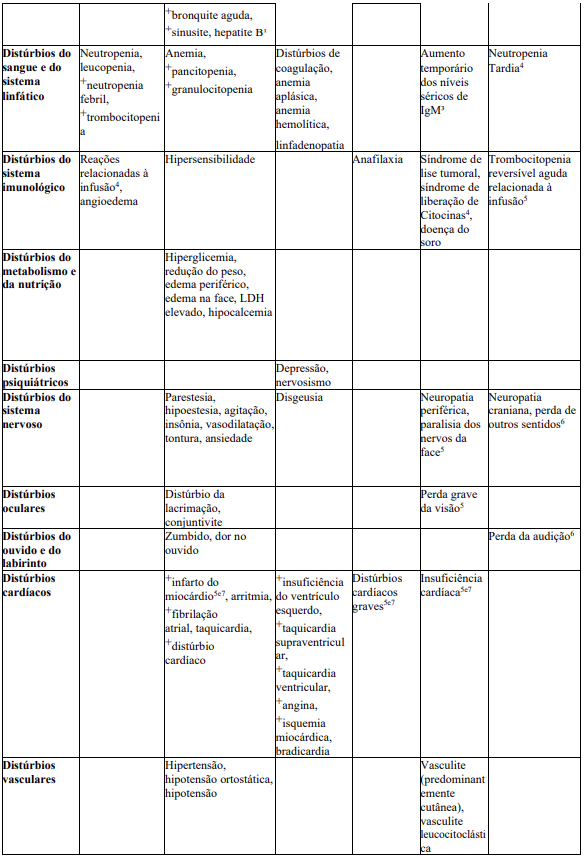
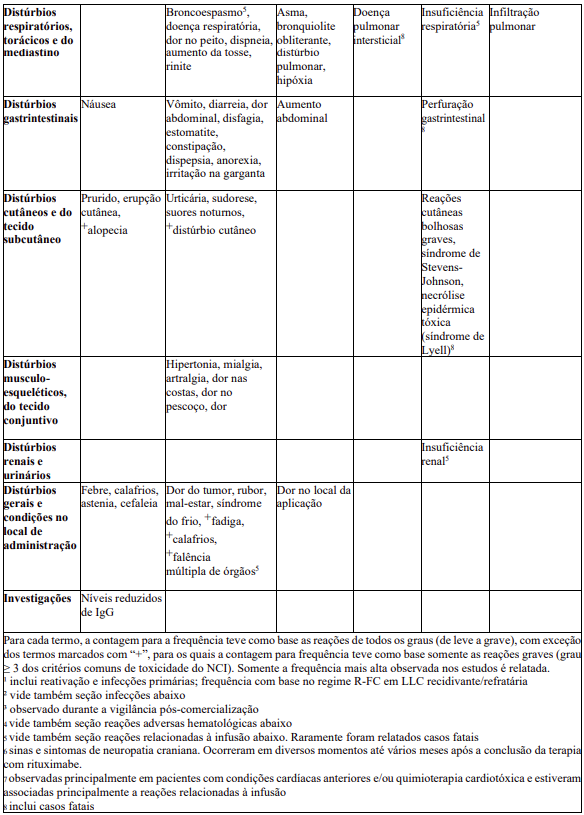
Relação em tabela das reações adversas
As frequências de RAMs relatadas com MabThera® isolado ou em combinação com quimioterapia são resumidas na Tabela 8. Dentro de cada agrupamento de frequência, os efeitos indesejáveis são apresentados em ordem decrescente de seriedade. As frequências são definidas como muito comum (≥ 1/10), comum (≥ 1/100 a < 1/10), incomum (≥ 1/1.000 a < 1/100), rara (≥ 1/10.000 a < 1/1.000), muito rara (< 1/10.000) e desconhecida (não pode ser estimada com base nos dados disponíveis). Dentro de cada frequência por agrupamento, os efeitos indesejáveis são apresentados em ordem de seriedade.
As RAMs identificadas somente durante a vigilância pós-comercialização, e para as quais a frequência não pôde ser estimada, são listadas como “desconhecida”.
Contraindicações
É contraindicado a pacientes com hipersensibilidade conhecida ao rituximabe ou a proteínas murinas ou a qualquer um dos seus excipientes.
Contraindicações da utilização em linfoma não Hodgkin e leucemia linfoide crônica:
– Infecções ativas e graves.
– Pacientes em estado gravemente imunocomprometido.
– Uso contraindicado no aleitamento ou na doação de leite humano: Este medicamento é contraindicado durante o aleitamento ou doação de leite, pois é excretado no leite humano e pode causar reações indesejáveis no bebê. Seu médico ou cirurgião-dentista deve apresentar alternativas para o seu tratamento ou para a alimentação do bebê.
Fonte
Vivaxxia®. [Bula]. São Paulo: Libbs Farmacêutica Ltda. Disponível em: https://consultas.anvisa.gov.br/#/bulario/q/?numeroRegistro=100330205: 28/08/2025
