Nome Comercial/ Apresentação
Stivarga (regorafenibe) 40mg / Comprimidos revestidos
Classe Terapêutica
Agentes antineoplásicos
Indicação
Regorafenibe é indicado para o tratamento de pacientes adultos com:
– tumores estromais gastrintestinais (GIST) metastáticos ou não ressecáveis, que tenham progredido ou experimentaram intolerância ao tratamento prévio com imatinibe e sunitinibe.
– carcinoma hepatocelular (CHC) que tenham sido previamente tratados com sorafenibe.
– câncer colorretal (CCR) metastático que tenham sido previamente tratados com, ou não sejam considerados candidatos para, as terapias disponíveis. Estas incluem quimioterapia à base de fluoropirimidinas, terapia anti-VEGF e terapia anti-EGFR.
Dose
A dose recomendada é de 160 mg de regorafenibe (4 comprimidos revestidos contendo 40mg de regorafenibe cada) ingeridos via oral uma vez ao dia durante 3 semanas de terapia, seguido de 1 semana sem terapia para compreender um ciclo de 4 semanas.
Os comprimidos revestidos devem ser ingeridos inteiros com água, na mesma hora de cada dia, após refeição leve que contenha menos que 30% de gordura. Exemplo de refeição leve inclui uma xícara de cereal, 250mL ou um copo de leite desnatado, uma torrada com geleia, suco de maçã e uma xícara de café ou chá (520 calorias, 2g de gordura, 17g de proteína, 93g de carboidrato).
Se uma dose de regorafenibe for esquecida, a mesma deve ser ingerida no mesmo dia, assim que o paciente se lembrar. O paciente não deve ingerir duas doses no mesmo dia para compensar uma dose esquecida. No caso de vômito após a administração, o paciente não deve ingerir comprimidos adicionais.
O tratamento deve continuar enquanto os benefícios forem observados ou até que ocorra toxicidade inaceitável.
Modificação da dose
A interrupção e/ou redução da dose podem ser necessárias baseado na segurança e tolerabilidade individual. Modificações da dose devem ser aplicadas a cada 40mg (um comprimido). A dose diária mais baixa recomendada é de 80mg. A dose diária máxima é de 160mg.
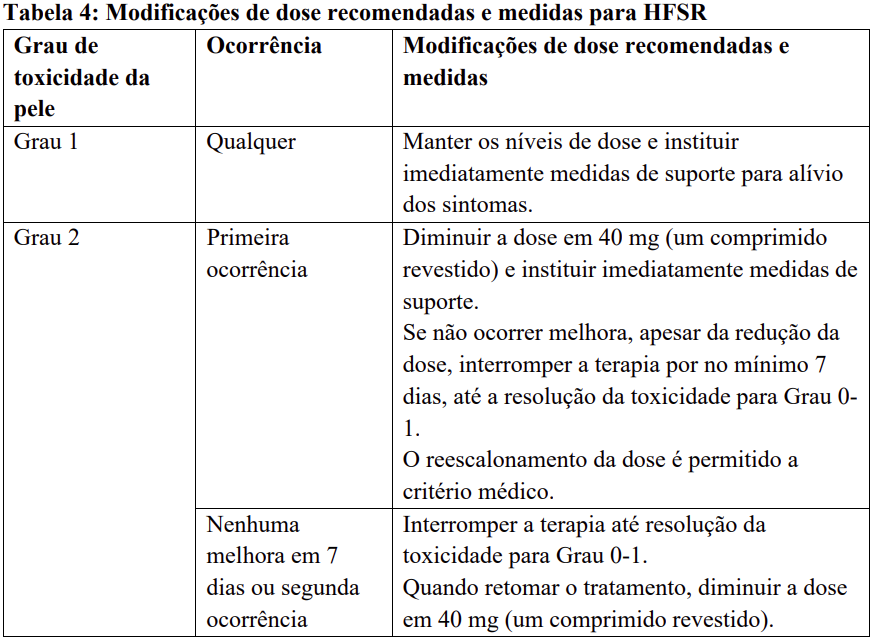
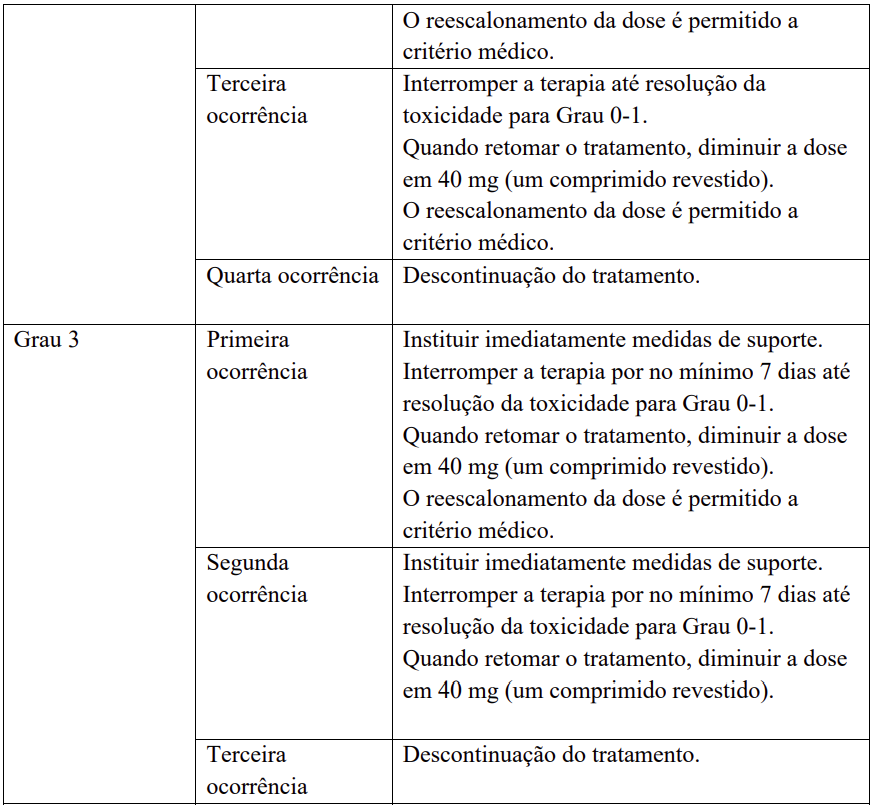
Para modificações recomendadas da dose e medidas em caso de reações cutâneas mão-pé (HFSR/síndrome de eritrodisestesia palmo-plantar) – veja Tabela 4.
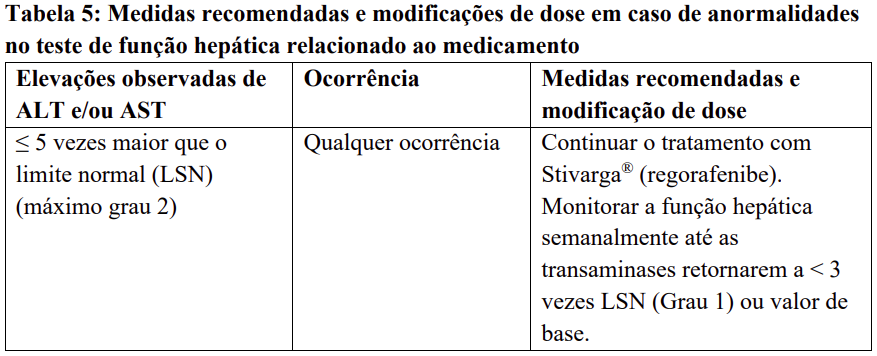
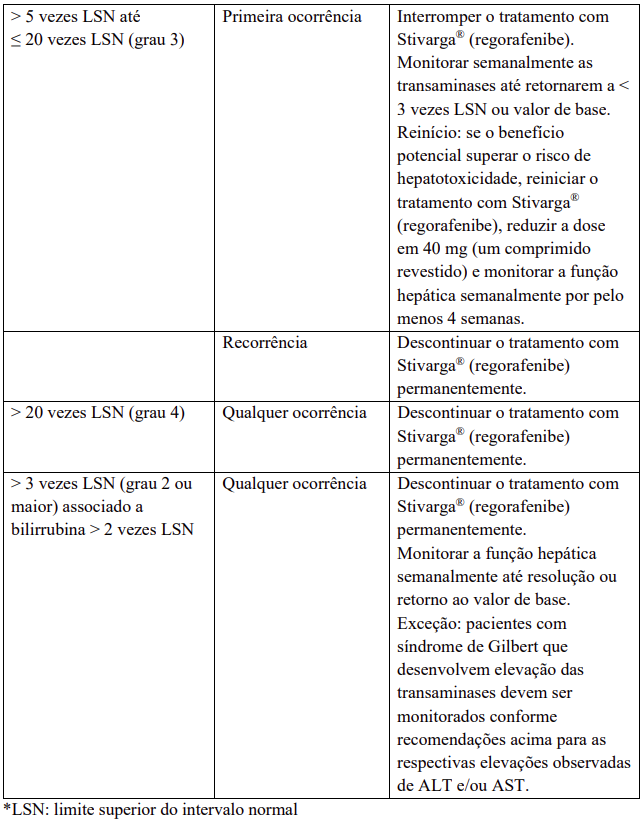
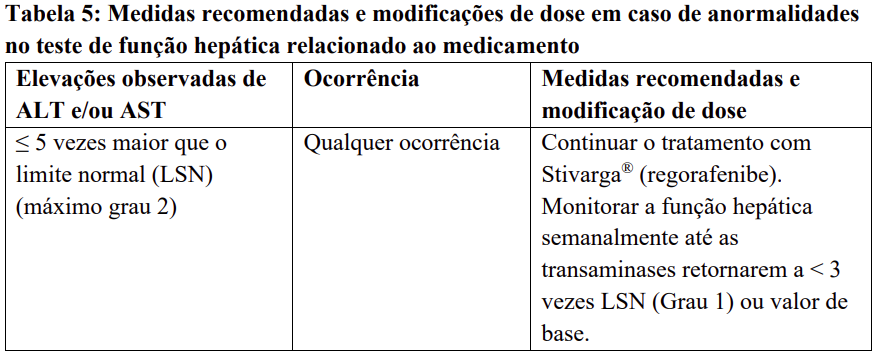
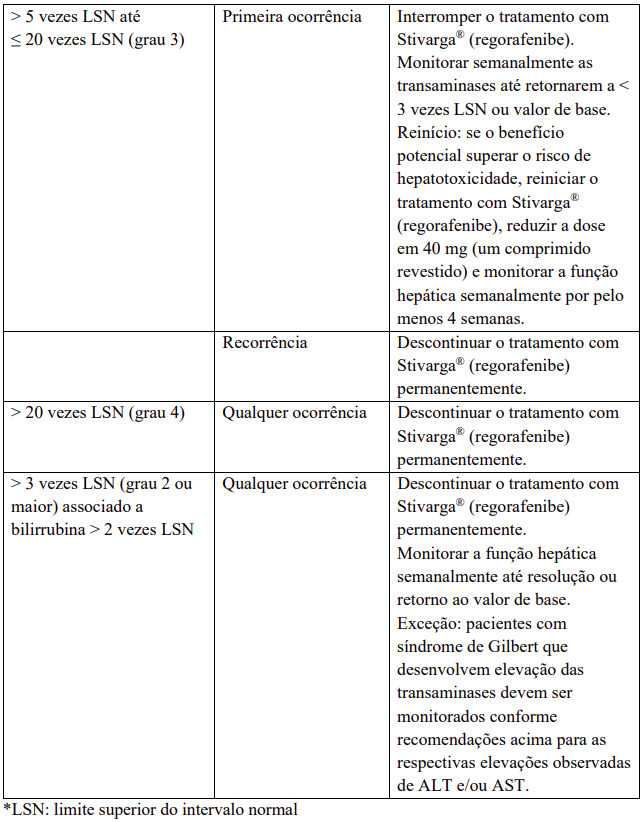
Para medidas recomendadas e modificações de dose em caso de agravamento dos testes de função hepática considerados relacionados ao tratamento com regorafenibe, veja Tabela 5.
Ajuste de dose
Insuficiência renal: Nenhum ajuste de dose é necessário em pacientes com insuficiência renal leve, moderada ou grave.
Insuficiência hepática: Nenhum ajuste de dose é necessário em pacientes com insuficiência hepática leve ou moderada. Não é recomendado para uso em pacientes com insuficiência hepática grave uma vez que não foi estudado nesta população.
Vias de administração
ORAL
Administração
Pressione o sistema de fechamento para baixo de acordo com as instruções da tampa enquanto gira a mesma para a esquerda. Mantenha o frasco hermeticamente fechado após primeira abertura. O dessecante contido no frasco não deve ser ingerido.
Qualquer medicamento não utilizado ou material de descarte deve ser eliminado de acordo com os requerimentos locais. Este medicamento não deve ser partido, aberto ou mastigado.
Cuidados específicos e monitoramento
Alterações em testes laboratoriais bioquímicos e metabólicos
Regorafenibe tem sido associado com incidência aumentada de anormalidades eletrolíticas (incluindo hipofosfatemia, hipocalcemia, hiponatremia e hipocalemia) e anormalidades metabólicas (incluindo aumento do hormônio estimulante da tireoide, lipase e amilase). As anormalidades são geralmente de gravidade leve a moderada, não associadas com manifestações clínicas e, geralmente, não requerem interrupção ou redução da dose. Recomenda-se monitorar os parâmetros bioquímicos e metabólicos durante o tratamento e instituir, se necessário, terapia de reposição adequada de acordo com a prática clínica padrão. Devem ser consideradas a interrupção ou redução da dose, ou descontinuação permanente em casos de anormalidades significativas persistentes ou recorrentes.
Gravidez, Lactação e Fertilidade
– Contracepção
Mulheres em idade reprodutiva devem ser informadas que regorafenibe pode causar dano fetal.
Mulheres em idade reprodutiva e homens devem garantir contracepção efetiva durante o tratamento e até 8 semanas após completar o tratamento.
– Gravidez
Não há dados sobre o uso de regorafenibe em mulheres grávidas.
Baseado em seu mecanismo de ação, suspeita-se que regorafenibe cause dano fetal quando administrado durante a gravidez.
Estudos em animais demonstraram toxicidade reprodutiva.
Não deve ser utilizado durante a gravidez a menos que seja claramente necessário e após cuidadosa avaliação dos benefícios para a mãe e do risco para o feto.
Categoria D – Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica.
– Lactação
Não se sabe se regorafenibe ou seus metabólitos são excretados no leite humano.
Em ratos, regorafenibe ou seus metabólitos são excretados no leite.
O risco para o lactente não pode ser excluído. O regorafenibe pode causar dano no crescimento e desenvolvimento infantil.
A amamentação deve ser descontinuada durante o tratamento e por 2 semanas após a última dose.
– Fertilidade
Não há dados sobre o efeito na fertilidade humana.
Resultados de estudos em animais indicam que regorafenibe pode prejudicar a fertilidade masculina e feminina.
Habilidade para dirigir veículos ou operar máquinas
Não foi conduzido estudo sobre o efeito na habilidade de dirigir veículos ou usar máquinas. Se os pacientes experimentarem sintomas que afetem sua capacidade de concentração e reação durante o tratamento, eles devem ser orientados a não conduzir veículos ou operar máquinas.
Interações medicamentosas
Inibidores/Indutores de CYP3A4
Dados in vitro indicam que regorafenibe é metabolizado pelo citocromo CYP3A4 e uridina difosfato glicuronosil transferase UGT1A9.
Administração de cetoconazol (400mg por 18 dias), um potente inibidor de CYP3A4, com uma dose única de regorafenibe (160mg no dia 5) resultou em um aumento na exposição média (AUC) de regorafenibe de aproximadamente 33% e uma diminuição na exposição média dos metabólitos ativos M-2 (N-óxido) e M-5 (N-óxido e Ndesmetil) de aproximadamente 90%. É recomendável evitar o uso concomitante de inibidores potentes da atividade do CYP3A4 (por exemplo, claritromicina, suco de toranja (“grapefruit”), itraconazol, cetoconazol, posaconazol, telitromicina e voriconazol) uma vez que a sua influência sobre a exposição em estado de equilíbrio de regorafenibe e seus metabólitos (M-2 e M-5) não foi estudada.
Administração de rifampicina (600mg por 9 dias), um potente indutor de CYP3A4, com uma dose única de regorafenibe (160mg no dia 7) resultou em redução na exposição média (AUC) de regorafenibe de aproximadamente 50%, aumento de 3 a 4 vezes na exposição média do metabólito ativo M-5 e nenhuma alteração na exposição do metabólito ativo M-2. Outros indutores potentes de CYP3A4 (por exemplo, fenitoína, carbamazepina, fenobarbital, erva de São João) também podem aumentar o metabolismo de regorafenibe. Uma vez que a redução das concentrações plasmáticas de regorafenibe pode resultar em diminuição da eficácia, devem ser evitados indutores potentes de CYP3A4, ou deve ser considerada a seleção de um medicamento concomitante alternativo, com nenhum ou mínimo potencial para indução de CYP3A4.
Inibidores/Indutores da proteína de resistência ao câncer de mama (BCRP) e glicoproteína-P
Dados in vitro indicam que os metabólitos ativos M-2 e M-5 são substratos BCRP e glicoproteína-P. Inibidores e indutores da BCRP e glicoproteína-P podem interferir com a exposição de M-2 e M-5. A significância clínica destes achados é desconhecida.
Substratos UGT1A1 e UGT1A9
Dados in vitro indicam que regorafenibe, assim como seu metabólito ativo M-2, inibe a glicuronidação mediada por uridina difosfato glicuronosil transferase UGT1A1 e UGT1A9, enquanto que M-5 somente inibe UGT1A1 com concentrações que são alcançadas in vivo no estado de equilíbrio.
A administração de regorafenibe com intervalo de 5 dias antes da administração de irinotecano resultou em aumento de aproximadamente 44% na exposição média (AUC) de SN-38, um substrato da UGT1A1 e um metabólito ativo do irinotecano. Foi observado também um aumento na AUC de irinotecano de aproximadamente 28%.
Isso indica que a coadministração de regorafenibe pode aumentar a exposição sistêmica aos substratos UGT1A1 e UGT1A9. A significância clínica destes achados é desconhecida.
Substratos BCRP (proteína de resistência ao câncer de mama) e glicoproteína-P
A administração de regorafenibe (160mg durante 14 dias) antes da administração de uma única dose de rosuvastatina (5mg), um substrato BCRP, resultou em um aumento de 3,8 vezes na exposição média (AUC) da rosuvastatina e um aumento de 4,6 vezes da Cmax.
Isto indica que a coadministração de regorafenibe pode aumentar as concentrações plasmáticas de outros substratos BCRP concomitantes (por exemplo, metotrexato, fluvastatina, atorvastatina). Portanto, recomenda-se monitorar cuidadosamente os pacientes para sinais e sintomas de aumento da exposição a substratos BCRP.
Os dados clínicos indicam que regorafenibe não tem efeito sobre a farmacocinética da digoxina, portanto, pode ser administrado concomitantemente com substratos da glicoproteína-P, tais como digoxina, sem interação medicamentosa clinicamente significante.
Substratos seletivos isoforma CYP
Dados in vitro indicam que regorafenibe é um inibidor competitivo do citocromo CYP2C8 (valor Ki de 0,6 micromolar), CYP2C9 (valor Ki de 4,7 micromolar), CYP2B6 (valor Ki de 5,2 micromolar) a concentrações que são alcançadas in vivo no estado de equilíbrio (pico de contração plasmática de 8,1 micromolar). A potência inibitória in vitro para CYP3A4 (valor Ki de 11,1 micromolar) e CYP2C19 (valor Ki de 16,4 micromolar) foi menos pronunciada.
Um estudo clínico de substrato exploratório foi realizado para avaliar o efeito de 14 dias de dosagem com 160 mg de regorafenibe sobre a farmacocinética de substratos exploratórios de CYP2C8 (rosiglitazona), CYP2C9 (varfarina S), CYP2C19 (omeprazol) e CYP3A4 (midazolam).
Dados farmacocinéticos indicam que regorafenibe pode ser administrado concomitantemente com substratos de CYP2C8, CYP2C9, CYP3A4 e CYP2C19 sem interação medicamentosa clinicamente significante.
Antibióticos
O perfil de concentração-tempo indica que regorafenibe e seus metabólitos podem sofrer circulação êntero-hepática. A coadministração com neomicina, um agente antimicrobiano pouco absorvido, utilizado para a erradicação da microflora gastrintestinal (o qual pode interferir com a circulação êntero-hepática de regorafenibe), não teve efeito sobre a exposição de regorafenibe. Houve uma diminuição significativa na exposição dos metabolitos ativos M-2 e M-5. Efeitos de outros antibióticos não foram estudados. A significância clínica do efeito da neomicina e de interações potenciais com outros antibióticos é desconhecida, mas pode resultar em diminuição da eficácia de regorafenibe.
Agentes sequestrantes dos sais biliares
O regorafenibe, M-2 e M-5 podem ser sujeitos à circulação êntero-hepática. Os agentes sequestrantes dos sais biliares tais como a colestiramina e o cholestagel podem interagir com o regorafenibe formando complexos insolúveis que podem influenciar a absorção (ou reabsorção), resultando em potencial diminuição da exposição. O significado clínico destas potenciais interações é desconhecido, mas pode resultar em diminuição da eficácia de regorafenibe.
Estabilidade/ Conservação
O medicamento deve ser mantido em temperatura ambiente (entre 15ºC e 30°C). Proteger da umidade. Mantenha o produto em sua embalagem original para protegê-lo da umidade. Mantenha o dessecante dentro do frasco. Mantenha o frasco hermeticamente fechado após primeira abertura. Uma vez aberto, o medicamento demonstrou ser estável durante 4 semanas, mesmo sem o dessecante. Depois disto, o medicamento deve ser descartado. Após aberto, válido por 28 dias.
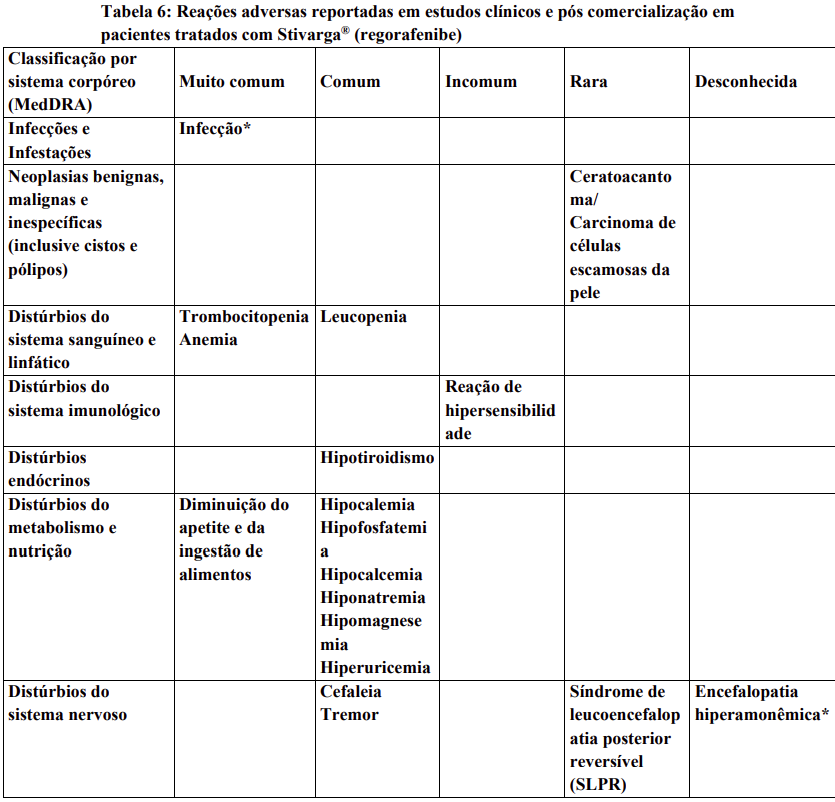
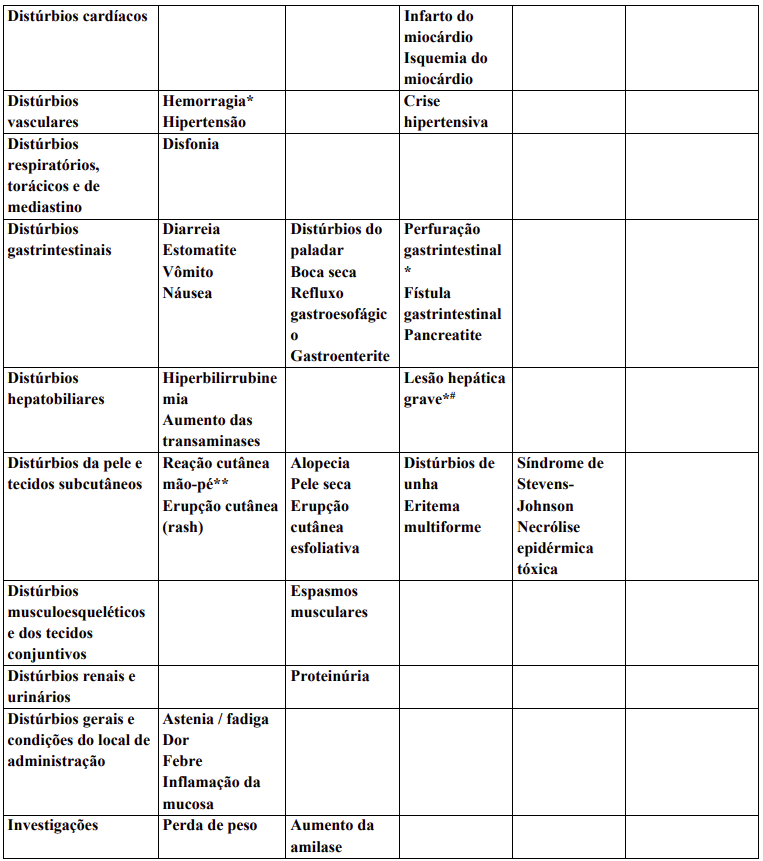
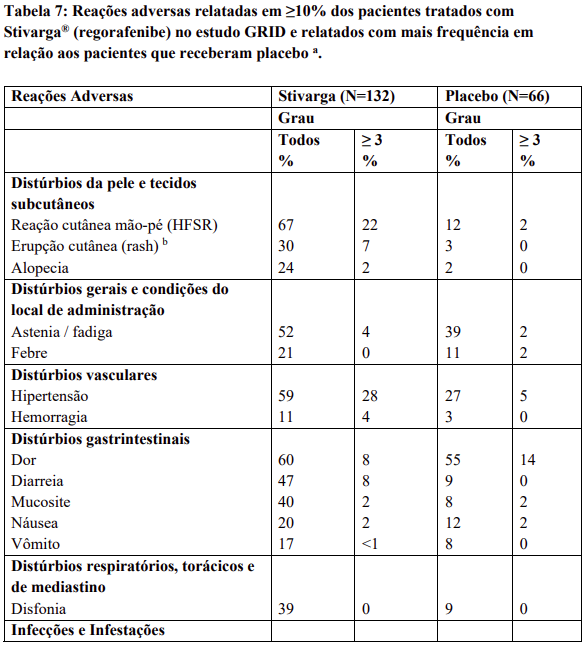
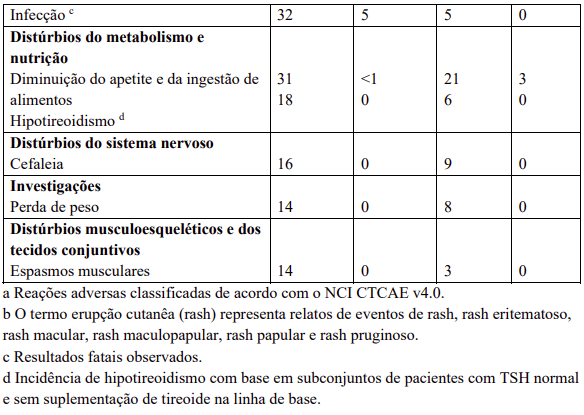
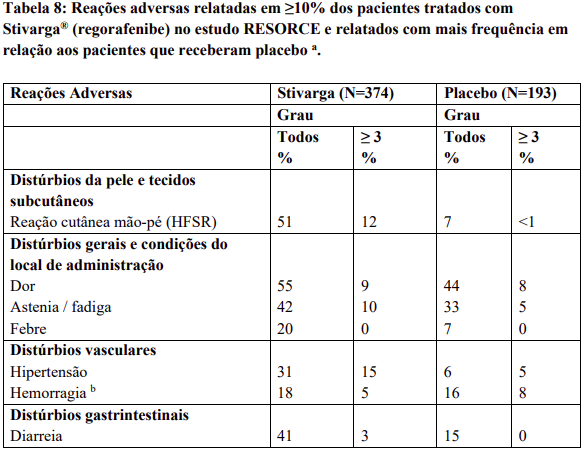
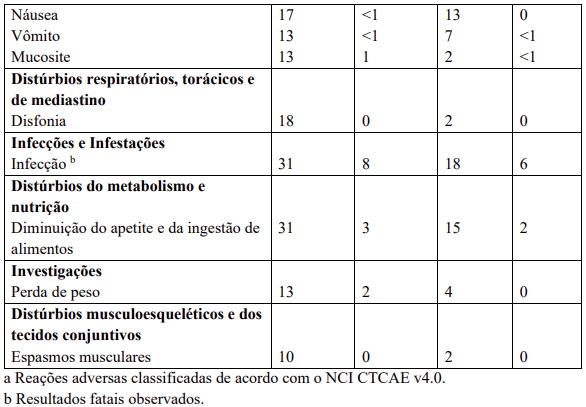
Reações adversas
Reações adversas estão agrupadas de acordo com a sua frequência. Os grupos de frequência são definidos pela seguinte convenção: Muito comum: ≥ 1 / 10; Comum: ≥ 1 / 100 a < 1 / 10; Incomum: ≥ 1 / 1.000 a < 1 / 100; Rara: ≥ 1 / 10.000 a < 1 / 1.000; Desconhecida (não pode ser estimada a partir dos dados disponíveis).
Dentro de cada grupo de frequência, efeitos indesejáveis estão presentes em ordem decrescente de gravidade.
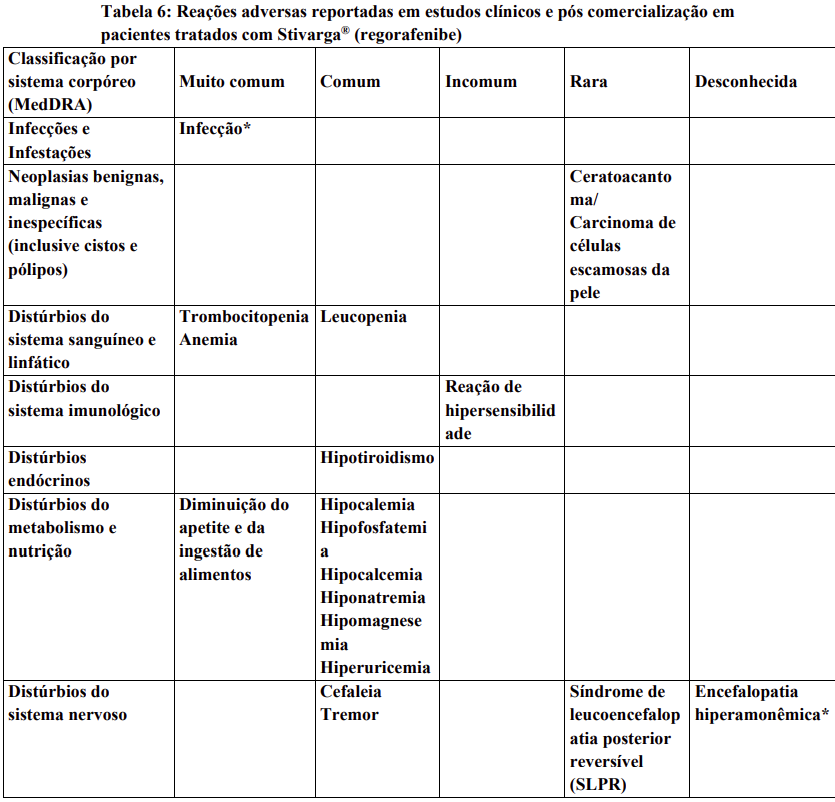
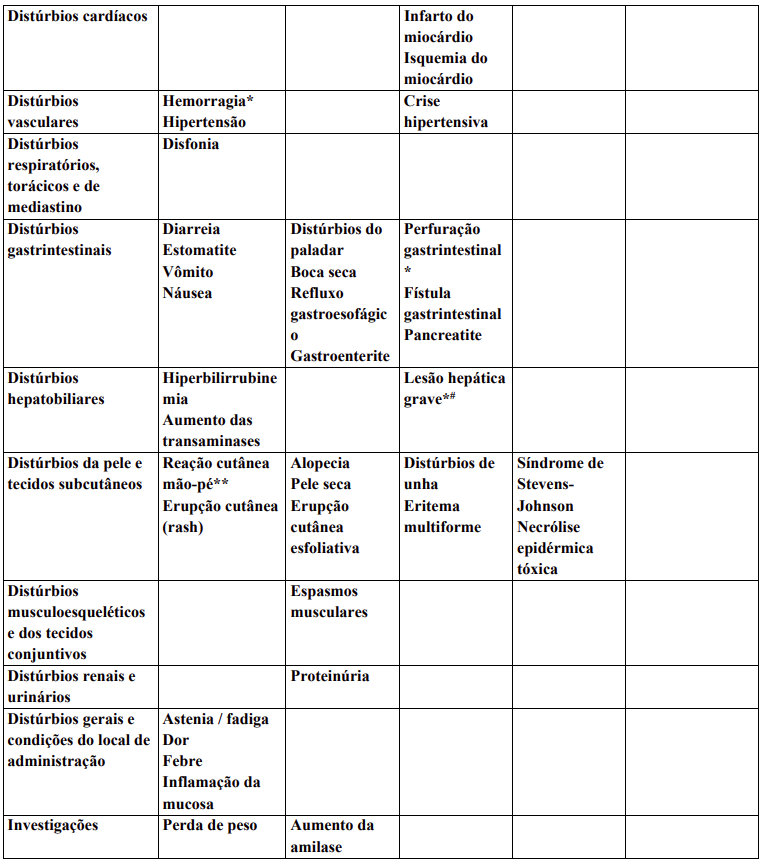

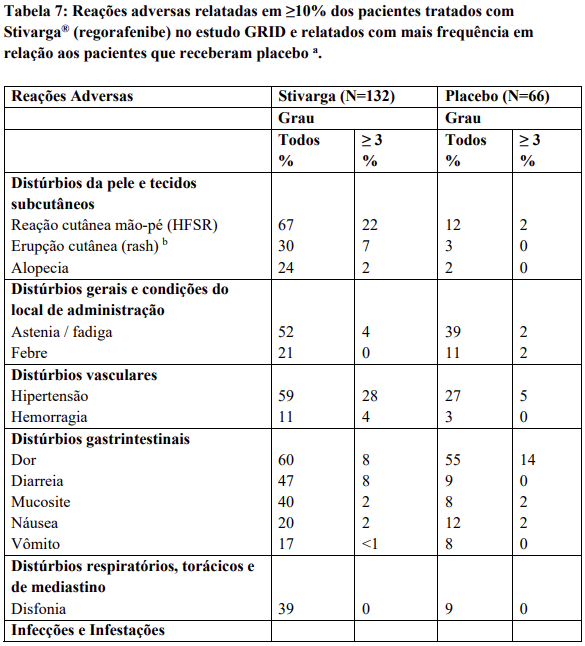
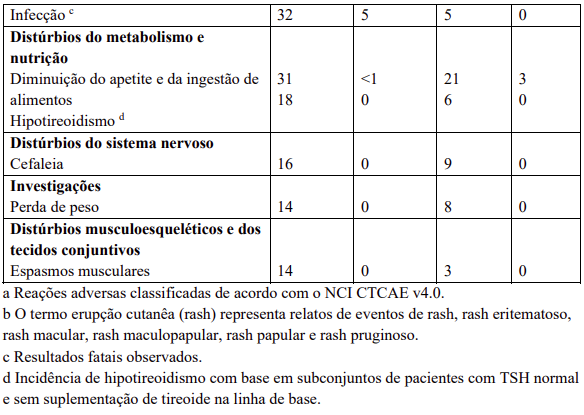
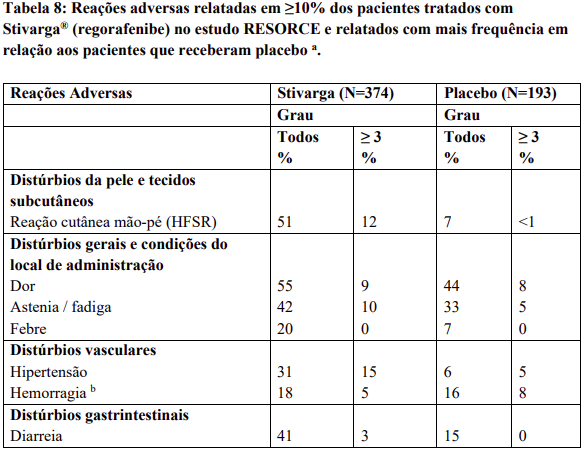
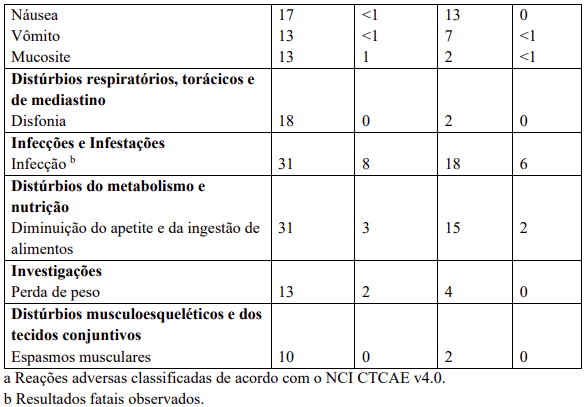
Contraindicações
Hipersensibilidade ao princípio ativo ou a algum dos excipientes do medicamento regorafenibe.
Fonte
Stivarga®. [Bula]. São Paulo: Bayer S.A. Disponível em: https://consultas.anvisa.gov.br/#/bulario/q/?numeroRegistro=170560108: 28/08/2025
Nome Comercial/ Apresentação
Stivarga (regorafenibe) 40mg / Comprimidos revestidos
Classe Terapêutica
Agentes antineoplásicos
Indicação
Regorafenibe é indicado para o tratamento de pacientes adultos com:
– tumores estromais gastrintestinais (GIST) metastáticos ou não ressecáveis, que tenham progredido ou experimentaram intolerância ao tratamento prévio com imatinibe e sunitinibe.
– carcinoma hepatocelular (CHC) que tenham sido previamente tratados com sorafenibe.
– câncer colorretal (CCR) metastático que tenham sido previamente tratados com, ou não sejam considerados candidatos para, as terapias disponíveis. Estas incluem quimioterapia à base de fluoropirimidinas, terapia anti-VEGF e terapia anti-EGFR.
Dose
A dose recomendada é de 160 mg de regorafenibe (4 comprimidos revestidos contendo 40mg de regorafenibe cada) ingeridos via oral uma vez ao dia durante 3 semanas de terapia, seguido de 1 semana sem terapia para compreender um ciclo de 4 semanas.
Os comprimidos revestidos devem ser ingeridos inteiros com água, na mesma hora de cada dia, após refeição leve que contenha menos que 30% de gordura. Exemplo de refeição leve inclui uma xícara de cereal, 250mL ou um copo de leite desnatado, uma torrada com geleia, suco de maçã e uma xícara de café ou chá (520 calorias, 2g de gordura, 17g de proteína, 93g de carboidrato).
Se uma dose de regorafenibe for esquecida, a mesma deve ser ingerida no mesmo dia, assim que o paciente se lembrar. O paciente não deve ingerir duas doses no mesmo dia para compensar uma dose esquecida. No caso de vômito após a administração, o paciente não deve ingerir comprimidos adicionais.
O tratamento deve continuar enquanto os benefícios forem observados ou até que ocorra toxicidade inaceitável.
Modificação da dose
A interrupção e/ou redução da dose podem ser necessárias baseado na segurança e tolerabilidade individual. Modificações da dose devem ser aplicadas a cada 40mg (um comprimido). A dose diária mais baixa recomendada é de 80mg. A dose diária máxima é de 160mg.
Para modificações recomendadas da dose e medidas em caso de reações cutâneas mão-pé (HFSR/síndrome de eritrodisestesia palmo-plantar) – veja Tabela 4.
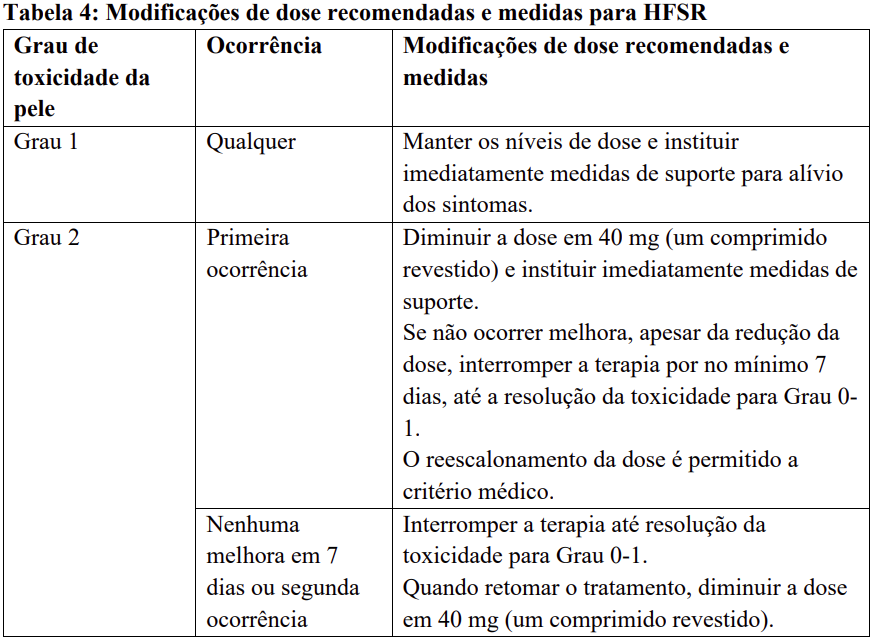
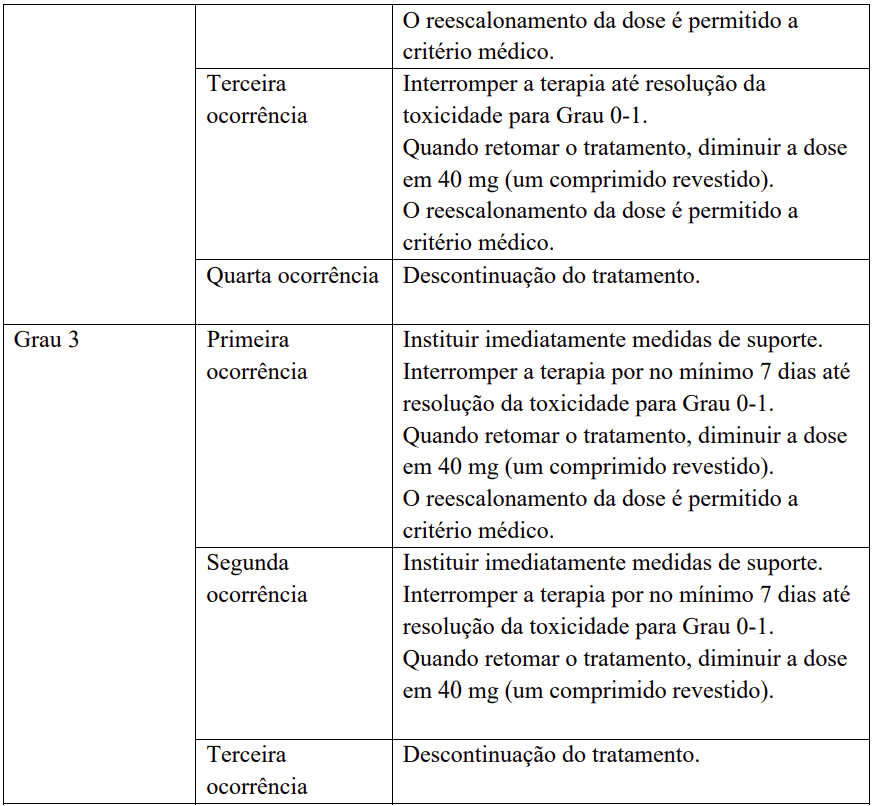
Para medidas recomendadas e modificações de dose em caso de agravamento dos testes de função hepática considerados relacionados ao tratamento com regorafenibe, veja Tabela 5.
Ajuste de dose
Insuficiência renal: Nenhum ajuste de dose é necessário em pacientes com insuficiência renal leve, moderada ou grave.
Insuficiência hepática: Nenhum ajuste de dose é necessário em pacientes com insuficiência hepática leve ou moderada. Não é recomendado para uso em pacientes com insuficiência hepática grave uma vez que não foi estudado nesta população.
Vias de administração
ORAL
Administração
Pressione o sistema de fechamento para baixo de acordo com as instruções da tampa enquanto gira a mesma para a esquerda. Mantenha o frasco hermeticamente fechado após primeira abertura. O dessecante contido no frasco não deve ser ingerido.
Qualquer medicamento não utilizado ou material de descarte deve ser eliminado de acordo com os requerimentos locais. Este medicamento não deve ser partido, aberto ou mastigado.
Cuidados específicos e monitoramento
Alterações em testes laboratoriais bioquímicos e metabólicos
Regorafenibe tem sido associado com incidência aumentada de anormalidades eletrolíticas (incluindo hipofosfatemia, hipocalcemia, hiponatremia e hipocalemia) e anormalidades metabólicas (incluindo aumento do hormônio estimulante da tireoide, lipase e amilase). As anormalidades são geralmente de gravidade leve a moderada, não associadas com manifestações clínicas e, geralmente, não requerem interrupção ou redução da dose. Recomenda-se monitorar os parâmetros bioquímicos e metabólicos durante o tratamento e instituir, se necessário, terapia de reposição adequada de acordo com a prática clínica padrão. Devem ser consideradas a interrupção ou redução da dose, ou descontinuação permanente em casos de anormalidades significativas persistentes ou recorrentes.
Gravidez, Lactação e Fertilidade
– Contracepção
Mulheres em idade reprodutiva devem ser informadas que regorafenibe pode causar dano fetal.
Mulheres em idade reprodutiva e homens devem garantir contracepção efetiva durante o tratamento e até 8 semanas após completar o tratamento.
– Gravidez
Não há dados sobre o uso de regorafenibe em mulheres grávidas.
Baseado em seu mecanismo de ação, suspeita-se que regorafenibe cause dano fetal quando administrado durante a gravidez.
Estudos em animais demonstraram toxicidade reprodutiva.
Não deve ser utilizado durante a gravidez a menos que seja claramente necessário e após cuidadosa avaliação dos benefícios para a mãe e do risco para o feto.
Categoria D – Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica.
– Lactação
Não se sabe se regorafenibe ou seus metabólitos são excretados no leite humano.
Em ratos, regorafenibe ou seus metabólitos são excretados no leite.
O risco para o lactente não pode ser excluído. O regorafenibe pode causar dano no crescimento e desenvolvimento infantil.
A amamentação deve ser descontinuada durante o tratamento e por 2 semanas após a última dose.
– Fertilidade
Não há dados sobre o efeito na fertilidade humana.
Resultados de estudos em animais indicam que regorafenibe pode prejudicar a fertilidade masculina e feminina.
Habilidade para dirigir veículos ou operar máquinas
Não foi conduzido estudo sobre o efeito na habilidade de dirigir veículos ou usar máquinas. Se os pacientes experimentarem sintomas que afetem sua capacidade de concentração e reação durante o tratamento, eles devem ser orientados a não conduzir veículos ou operar máquinas.
Interações medicamentosas
Inibidores/Indutores de CYP3A4
Dados in vitro indicam que regorafenibe é metabolizado pelo citocromo CYP3A4 e uridina difosfato glicuronosil transferase UGT1A9.
Administração de cetoconazol (400mg por 18 dias), um potente inibidor de CYP3A4, com uma dose única de regorafenibe (160mg no dia 5) resultou em um aumento na exposição média (AUC) de regorafenibe de aproximadamente 33% e uma diminuição na exposição média dos metabólitos ativos M-2 (N-óxido) e M-5 (N-óxido e Ndesmetil) de aproximadamente 90%. É recomendável evitar o uso concomitante de inibidores potentes da atividade do CYP3A4 (por exemplo, claritromicina, suco de toranja (“grapefruit”), itraconazol, cetoconazol, posaconazol, telitromicina e voriconazol) uma vez que a sua influência sobre a exposição em estado de equilíbrio de regorafenibe e seus metabólitos (M-2 e M-5) não foi estudada.
Administração de rifampicina (600mg por 9 dias), um potente indutor de CYP3A4, com uma dose única de regorafenibe (160mg no dia 7) resultou em redução na exposição média (AUC) de regorafenibe de aproximadamente 50%, aumento de 3 a 4 vezes na exposição média do metabólito ativo M-5 e nenhuma alteração na exposição do metabólito ativo M-2. Outros indutores potentes de CYP3A4 (por exemplo, fenitoína, carbamazepina, fenobarbital, erva de São João) também podem aumentar o metabolismo de regorafenibe. Uma vez que a redução das concentrações plasmáticas de regorafenibe pode resultar em diminuição da eficácia, devem ser evitados indutores potentes de CYP3A4, ou deve ser considerada a seleção de um medicamento concomitante alternativo, com nenhum ou mínimo potencial para indução de CYP3A4.
Inibidores/Indutores da proteína de resistência ao câncer de mama (BCRP) e glicoproteína-P
Dados in vitro indicam que os metabólitos ativos M-2 e M-5 são substratos BCRP e glicoproteína-P. Inibidores e indutores da BCRP e glicoproteína-P podem interferir com a exposição de M-2 e M-5. A significância clínica destes achados é desconhecida.
Substratos UGT1A1 e UGT1A9
Dados in vitro indicam que regorafenibe, assim como seu metabólito ativo M-2, inibe a glicuronidação mediada por uridina difosfato glicuronosil transferase UGT1A1 e UGT1A9, enquanto que M-5 somente inibe UGT1A1 com concentrações que são alcançadas in vivo no estado de equilíbrio.
A administração de regorafenibe com intervalo de 5 dias antes da administração de irinotecano resultou em aumento de aproximadamente 44% na exposição média (AUC) de SN-38, um substrato da UGT1A1 e um metabólito ativo do irinotecano. Foi observado também um aumento na AUC de irinotecano de aproximadamente 28%.
Isso indica que a coadministração de regorafenibe pode aumentar a exposição sistêmica aos substratos UGT1A1 e UGT1A9. A significância clínica destes achados é desconhecida.
Substratos BCRP (proteína de resistência ao câncer de mama) e glicoproteína-P
A administração de regorafenibe (160mg durante 14 dias) antes da administração de uma única dose de rosuvastatina (5mg), um substrato BCRP, resultou em um aumento de 3,8 vezes na exposição média (AUC) da rosuvastatina e um aumento de 4,6 vezes da Cmax.
Isto indica que a coadministração de regorafenibe pode aumentar as concentrações plasmáticas de outros substratos BCRP concomitantes (por exemplo, metotrexato, fluvastatina, atorvastatina). Portanto, recomenda-se monitorar cuidadosamente os pacientes para sinais e sintomas de aumento da exposição a substratos BCRP.
Os dados clínicos indicam que regorafenibe não tem efeito sobre a farmacocinética da digoxina, portanto, pode ser administrado concomitantemente com substratos da glicoproteína-P, tais como digoxina, sem interação medicamentosa clinicamente significante.
Substratos seletivos isoforma CYP
Dados in vitro indicam que regorafenibe é um inibidor competitivo do citocromo CYP2C8 (valor Ki de 0,6 micromolar), CYP2C9 (valor Ki de 4,7 micromolar), CYP2B6 (valor Ki de 5,2 micromolar) a concentrações que são alcançadas in vivo no estado de equilíbrio (pico de contração plasmática de 8,1 micromolar). A potência inibitória in vitro para CYP3A4 (valor Ki de 11,1 micromolar) e CYP2C19 (valor Ki de 16,4 micromolar) foi menos pronunciada.
Um estudo clínico de substrato exploratório foi realizado para avaliar o efeito de 14 dias de dosagem com 160 mg de regorafenibe sobre a farmacocinética de substratos exploratórios de CYP2C8 (rosiglitazona), CYP2C9 (varfarina S), CYP2C19 (omeprazol) e CYP3A4 (midazolam).
Dados farmacocinéticos indicam que regorafenibe pode ser administrado concomitantemente com substratos de CYP2C8, CYP2C9, CYP3A4 e CYP2C19 sem interação medicamentosa clinicamente significante.
Antibióticos
O perfil de concentração-tempo indica que regorafenibe e seus metabólitos podem sofrer circulação êntero-hepática. A coadministração com neomicina, um agente antimicrobiano pouco absorvido, utilizado para a erradicação da microflora gastrintestinal (o qual pode interferir com a circulação êntero-hepática de regorafenibe), não teve efeito sobre a exposição de regorafenibe. Houve uma diminuição significativa na exposição dos metabolitos ativos M-2 e M-5. Efeitos de outros antibióticos não foram estudados. A significância clínica do efeito da neomicina e de interações potenciais com outros antibióticos é desconhecida, mas pode resultar em diminuição da eficácia de regorafenibe.
Agentes sequestrantes dos sais biliares
O regorafenibe, M-2 e M-5 podem ser sujeitos à circulação êntero-hepática. Os agentes sequestrantes dos sais biliares tais como a colestiramina e o cholestagel podem interagir com o regorafenibe formando complexos insolúveis que podem influenciar a absorção (ou reabsorção), resultando em potencial diminuição da exposição. O significado clínico destas potenciais interações é desconhecido, mas pode resultar em diminuição da eficácia de regorafenibe.
Estabilidade/ Conservação
O medicamento deve ser mantido em temperatura ambiente (entre 15ºC e 30°C). Proteger da umidade. Mantenha o produto em sua embalagem original para protegê-lo da umidade. Mantenha o dessecante dentro do frasco. Mantenha o frasco hermeticamente fechado após primeira abertura. Uma vez aberto, o medicamento demonstrou ser estável durante 4 semanas, mesmo sem o dessecante. Depois disto, o medicamento deve ser descartado. Após aberto, válido por 28 dias.
Reações adversas
Reações adversas estão agrupadas de acordo com a sua frequência. Os grupos de frequência são definidos pela seguinte convenção: Muito comum: ≥ 1 / 10; Comum: ≥ 1 / 100 a < 1 / 10; Incomum: ≥ 1 / 1.000 a < 1 / 100; Rara: ≥ 1 / 10.000 a < 1 / 1.000; Desconhecida (não pode ser estimada a partir dos dados disponíveis).
Dentro de cada grupo de frequência, efeitos indesejáveis estão presentes em ordem decrescente de gravidade.

Contraindicações
Hipersensibilidade ao princípio ativo ou a algum dos excipientes do medicamento regorafenibe.
Fonte
Stivarga®. [Bula]. São Paulo: Bayer S.A. Disponível em: https://consultas.anvisa.gov.br/#/bulario/q/?numeroRegistro=170560108: 28/08/2025
