Nome Comercial/ Apresentação
Kesimpta (ofatumumabe) 20 mg/0,4 mL / Solução Injetável
Classe Terapêutica
Imunossupressores seletivos
Indicação
É indicado para o tratamento de pacientes adultos com formas recorrentes de esclerose múltipla (EMR).
Dose
A dose recomendada é de 20mg administrado por injeção subcutânea com:
– administração inicial nas semanas 1, 2 e 3, seguido de
– administração mensal subsequente, a partir da semana 5.
Doses omitidas
Se uma injeção for omitida, ela deve ser administrada o quanto antes, sem esperar até a próxima dose programada. Doses subsequentes devem ser administradas nos intervalos recomendados.
Ajuste de dose
Insuficiência renal: não há ajustes de dosagem previstos na bula do fabricante.
Insuficiência hepática: não há ajustes de dosagem previstos na bula do fabricante.
Vias de administração
SUBCUTÂNEA
Administração
Destina-se à autoadministração do paciente por injeção subcutânea.
Os locais habituais para injeções subcutâneas são o abdômen, a coxa e a parte superior externa do braço.
É recomendável que a primeira injeção seja aplicada sob a orientação de um profissional de saúde.
Instruções detalhadas de administração são fornecidas na seção “Instruções de uso”.
Cuidados específicos e monitoramento
Infecções
Recomenda-se avaliar o estado imunológico do paciente antes de iniciar a terapia. Com base no seu modo de ação, ofatumumabe tem o potencial de aumentar o risco de infecções. A administração deve ser adiada em pacientes com infecção ativa até que a infecção seja resolvida.
Medicamentos imunossupressores podem ativar focos primários de tuberculose. Esteja alerta quanto à possibilidade de surgimento de doença ativa, tomando os cuidados para o diagnóstico precoce e tratamento.
Leucoencefalopatia multifocal progressiva
Não foram relatados casos de leucoencefalopatia multifocal progressiva (LEMP) com ofatumumabe nos estudos clínicos em EMR. No entanto, como infecção pelo vírus John Cunningham (JC) resultando em LEMP foi observada em pacientes tratados com ofatumumabe para indicação de Leucemia Linfóide Crônica (LLC) (em doses substancialmente mais altas que o recomendado para EM, mas com duração menor de tratamento).
Além disso, a infecção pelo vírus JC causando LEMP também foi observada em pacientes tratados com outros anticorpos anti-CD20 e outras terapias para EM. Portanto, os médicos devem ficar atentos a quaisquer sintomas clínicos ou achados de ressonância magnética (RM) que possam sugerir LEMP. Caso haja suspeita de LEMP, o tratamento com deve ser suspenso até que LEMP tenha sido excluída. Se o diagnóstico de LEMP for confirmado, o tratamento deve ser descontinuado.
Reativação do vírus da hepatite B
Não foram identificados casos de reativação do vírus da hepatite B (HBV) nos estudos clínicos de em EMR. Entretanto, a reativação da hepatite B ocorreu em pacientes tratados com anticorpos anti-CD20 e, em alguns casos, resultou em hepatite fulminante, insuficiência hepática e morte em pacientes tratados com ofatumumabe intravenoso para indicação de leucemia linfática crônica em doses maiores que as recomendadas para indicação de EM, mas com duração menor de tratamento. Pacientes com hepatite B ativa não devem ser tratados com Kesimpta®. Testes para HBV devem ser realizados em todos os pacientes antes do início do tratamento. No mínimo, os testes devem incluir antígeno de superfície da hepatite B (HBsAg) e anticorpo anti-core da hepatite B (HBcAb). Eles podem ser complementados com outros marcadores apropriados de acordo com as diretrizes locais. Os pacientes com sorologia positiva para hepatite B (HBsAg ou HBcAb) devem consultar especialistas em doenças hepáticas antes do início do tratamento e devem ser monitorados e tratados de acordo com os padrões médicos locais para evitar a reativação da hepatite B.
Vacinação
Todas as imunizações devem ser administradas de acordo com as diretrizes de imunização pelo menos 4 semanas antes do início de Kesimpta® no caso de vacinas vivas ou vacinas vivas atenuadas e, sempre que possível, pelo menos 2 semanas antes do início no caso de vacinas inativadas.
Pode interferir na eficácia de vacinas inativadas. A segurança da imunização com vacinas vivas ou vacinas vivas atenuadas após a terapia com Kesimpta® não foi estudada. A vacinação com vacinas vivas ou vacinas vivas atenuadas não é recomendada durante o tratamento e após a descontinuação até a repleção de células B.
Vacinação de lactentes nascidos de mães tratadas durante a gravidez.
Em lactentes de mães tratadas durante a gravidez, vacinas vivas ou vacinas vivas atenuadas não devem ser administradas antes que a recuperação da contagem de células B tenha sido confirmada. A depleção de células B nesses lactentes pode aumentar os riscos de vacinas vivas ou vacinas vivas atenuadas. Vacinas inativadas podem ser administradas conforme indicado antes da recuperação da depleção de células B, porém a avaliação das respostas imunológicas às vacinas, incluindo consulta com um especialista qualificado, deve ser considerada para determinar se uma resposta imunológica protetora foi estabelecida.
Populações especiais
-Gravidez
Resumo de riscos
Existe uma quantidade limitada de dados sobre o uso de ofatumumabe em mulheres grávidas. Ofatumumabe pode atravessar a placenta e causar depleção de células B fetais com base nos achados de estudos em animais. Não foi observada teratogenicidade após a administração intravenosa de ofatumumabe a macacas prenhas durante a organogênese em doses equivalentes a pelo menos 160 vezes a dose terapêutica com base na ASC. Depleção transitória de células B periféricas e linfopenia foram relatadas em lactentes nascidos de mães expostas a outros anticorpos anti-CD20 durante a gravidez. A possível duração da depleção de células B em lactentes expostos ao ofatumumabe no útero e o impacto da depleção de células B na segurança e eficácia de vacinas são desconhecidos.
Kesimpta® enquadra-se na categoria C de risco na gravidez, portanto, este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica ou do cirurgião-dentista
Dados em animais
Os estudos de desenvolvimento embriofetal (EFD) e desenvolvimento pré/pós-natal aprimorado (ePPND) em macacos mostraram que a exposição ao ofatumumabe administrado por via intravenosa durante a gestação não causou toxicidade materna, teratogenicidade nem efeitos adversos no desenvolvimento embriofetal e pré/pós-natal. O NOAEL para esses parâmetros leva a margens de segurança com base na ASC de pelo menos 160 vezes em comparação com a exposição humana na dose terapêutica de 20mg por mês.
Nesses estudos, ofatumumabe foi detectado no sangue de fetos e filhotes, confirmando a transferência placentária e a exposição fetal ao ofatumumabe que persiste no período pós-natal (meia-vida longa do anticorpo monoclonal). A exposição ao ofatumumabe durante a gestação levou à depleção esperada de células B CD20+ em animais maternos e seus fetos e filhotes, juntamente com peso reduzido do baço (sem correlato histológico) nos fetos e resposta imune humoral reduzida à hemocianina de lapa californiana (KLH) em filhotes com altas doses. Todas essas alterações foram reversíveis durante o período pós-natal de 6 meses.
Nos filhotes, a mortalidade pós-natal precoce foi observada em uma dose 160 vezes maior do que a dose terapêutica (com base na ASC) e provavelmente foi decorrente de possíveis infecções secundárias à imunomodulação. O NOAEL relacionado à atividade farmacológica do ofatumumabe em filhotes do estudo ePPND leva a uma margem de segurança com base na ASC de pelo 22 vezes quando a exposição materna no NOAEL é comparada à exposição humana na dose terapêutica de 20mg por mês.
– Lactação
Resumo de riscos
O uso de ofatumumabe em mulheres durante a lactação não foi estudado. Não se sabe se o ofatumumabe é transferido para o leite humano; entretanto, a IgG humana está presente no leite humano. Não há dados sobre os efeitos no lactente ou na produção de leite. Dados publicados sugerem que os anticorpos no leite materno não entram na circulação neonatal e infantil em quantidades substanciais. Os benefícios da amamentação para o desenvolvimento e a saúde devem ser considerados, juntamente com a necessidade clínica de Kesimpta® da mãe e os possíveis efeitos adversos no lactente. Uso criterioso no aleitamento ou na doação de leite humano.
– Mulheres e homens com potencial reprodutivo
Contracepção
As mulheres com potencial para engravidar devem utilizar contracepção eficaz (métodos que resultam em taxas de gravidez inferiores a 1%) enquanto receberem Kesimpta® e por 6 meses após o último tratamento.
Fertilidade
Não há dados sobre o efeito do ofatumumabe na fertilidade humana.
Interações medicamentosas
Ofatumumabe não compartilha uma via de depuração comum com medicamentos químicos que são metabolizados pelo sistema do citocromo P450 ou por outras enzimas metabolizadoras de medicamentos. Ademais, não há evidências de que os anticorpos monoclonais (mAbs) anti-CD20 estejam envolvidos na regulação da expressão de enzimas metabolizadoras de medicamentos. Interações entre Kesimpta® e outros medicamentos não foram investigadas em estudos formais.
Vacinação
A segurança e a capacidade de gerar uma resposta primária ou anamnéstica (de memória) à imunização com vacinas vivas, vacinas vivas atenuadas ou vacinas inativadas durante o tratamento com ofatumumabe não foram investigadas. A resposta à vacinação pode ser prejudicada quando há depleção de células B. Recomenda-se que os pacientes completem as imunizações antes do início da terapia.
Outras terapias imunossupressoras ou imunomoduladoras
O risco de efeitos aditivos do sistema imunológico deve ser considerado ao administrar terapias imunossupressoras concomitantemente com Kesimpta®.
Quando for feita a troca de medicamentos com efeitos imunológicos prolongados, como ocrelizumabe, cladribina, fingolimode, natalizumabe, teriflunomida, mitoxantrona ou dimetil fumarato, a duração e o modo de ação desses medicamentos devem ser levados em consideração devido aos possíveis efeitos imunossupressores aditivos ao iniciar Kesimpta®.
Estabilidade/ Conservação
Deve ser armazenado sob refrigeração (entre 2ºC e 8ºC) em sua embalagem original para proteger da luz até o momento do uso. Não congelar. Se necessário, pode ser mantido fora da geladeira, uma única vez, por um período de até 7 dias a temperatura ambiente, não acima de 30ºC. Se não utilizado dentro dos 7 dias, o produto pode ser retornado e mantido sob refrigeração por, no máximo, 7 dias antes da sua utilização.
Reações adversas
Resumo do perfil de segurança
Aproximadamente 1500 pacientes com EMR receberam ofatumumabe em estudos clínicos. Nos dois estudos pivotais de Fase 3, 1882 pacientes com EMR foram randomizados, dos quais 946 foram tratados com ofatumumabe por uma duração mediana de 85 semanas; 33% dos pacientes que receberam ofatumumabe foram tratados por mais de 96 semanas (consulte a seção 2 Resultados de Eficácia). A proporção de pacientes com eventos adversos (EAs) (83,6% versus 84,2%) e EAs que levaram à descontinuação do medicamento (5,7% versus 5,2%) foi semelhante nos grupos de ofatumumabe e teriflunomida.
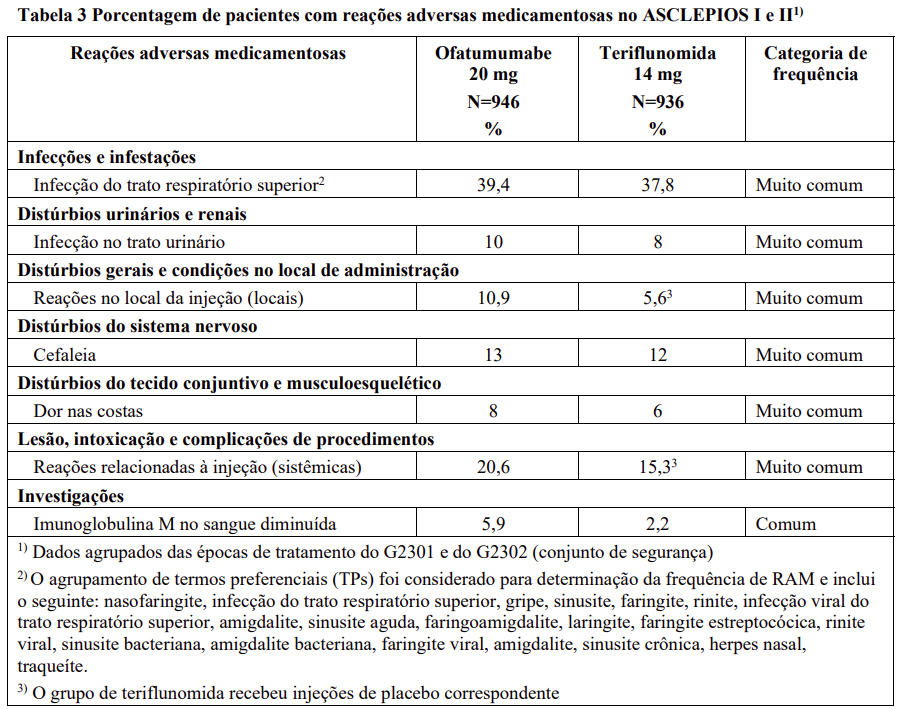
Resumo tabulado de reações adversas medicamentosas de estudos clínicos
As reações adversas medicamentosas que foram relatadas nos estudos clínicos pivotais estão listadas por classe de sistema de órgãos do MedDRA (Tabela 3). Em cada classe de sistema de órgãos, as reações adversas medicamentosas são classificadas por frequência, com as reações mais frequentes em primeiro. Em cada grupo de frequência, as reações adversas medicamentosas são apresentadas em ordem decrescente de gravidade. Além disso, a categoria de frequência correspondente para cada reação adversa medicamentosa baseia-se na seguinte convenção (CIOMS III): muito comum (≥1/10); comum (≥1/100 a <1/10); incomum (≥1/1.000 a <1/100); rara (≥1/10.000 a <1/1.000); muito rara (<1/10.000).
Reações adversas a medicamentos de relatos espontâneos e casos da literatura (frequência desconhecida)
As seguintes reações adversas foram derivadas da experiência pós-comercialização com Kesimpta® por meio de relatos de casos espontâneos e casos da literatura. Como essas reações são relatadas voluntariamente por uma população de tamanho incerto, não é possível estimar com segurança sua frequência, que é, portanto, categorizada como desconhecida. As reações adversas a medicamentos estão listadas de acordo com as classes de sistemas de órgãos no MedDRA. Dentro de cada classe de sistema de órgãos, as reações adversas a medicamentos são apresentadas em ordem decrescente de gravidade.

Descrição de reações adversas medicamentosas selecionadas
Infecções do trato respiratório superior
Uma proporção maior de pacientes tratados com ofatumumabe apresentou infecções do trato respiratório superior em comparação com pacientes tratados com teriflunomida. Nos estudos clínicos em EMR, 39,4% dos pacientes tratados com ofatumumabe apresentaram infecções do trato respiratório superior em comparação com 37,8% dos pacientes tratados com teriflunomida. As infecções foram predominantemente leves a moderadas e consistiram principalmente em nasofaringite, infecção do trato respiratório superior e influenza.
Reações relacionadas à injeção e reações no local da injeção
Nos pacientes tratados com ofatumumabe nos estudos clínicos de Fase 3 em EMR, reações relacionadas à injeção (sistêmicas) e reações no local da injeção (locais) foram relatadas em 20,6% e 10,9% dos pacientes tratados com ofatumumabe, respectivamente.
A incidência de reações relacionadas à injeção foi maior com a primeira injeção (14,4%), diminuindo significativamente com as injeções subsequentes (4,4% com a segunda, <3% a partir da terceira injeção). As reações relacionadas à injeção foram principalmente (99,8%) de intensidade leve a moderada. Apenas dois (0,2%) pacientes com EM tratados com ofatumumabe relataram reações relacionadas à injeção graves. Não houve reações relacionadas à injeção com risco à vida. Os sintomas relatados com maior frequência (≥2%) incluíram febre, cefaleia, mialgia, calafrios e fadiga.
Reações locais no local da administração foram muito comuns. Todas as reações no local da injeção foram de intensidade leve a moderada e de natureza não grave. Os sintomas relatados com maior frequência (≥2%) incluíram eritema, dor, coceira e inchaço.
Anormalidades laboratoriais
Imunoglobulinas
No decorrer dos estudos clínicos de Fase 3 em EMR, a diminuição no valor médio da imunoglobulina M (IgM) foi observada e não foi associada ao risco de infecções, incluindo infecções graves. Em 14,3% dos pacientes nos estudos clínicos de Fase 3 em EMR, o tratamento com Kesimpta® resultou em uma diminuição na IgM que chegou a um valor abaixo de 0,34 g/L. Não houve redução nos valores médios da imunoglobulina G (IgG).
Reações relacionadas à injeção
Os sintomas de reações no local da injeção (locais) observadas em estudos clínicos incluíram eritema, inchaço, coceira e dor. As reações sistêmicas relacionadas à injeção observadas em estudos clínicos ocorreram predominantemente com a primeira injeção. Os sintomas observados incluem febre, cefaleia, mialgia, calafrios e fadiga, e foram predominantemente (99,7%) não graves e de intensidade leve a moderada. Não houve reações à injeção com risco à vida nos estudos clínicos em EMR. As reações sistêmicas relacionadas à injeção adicionais relatadas no cenário pós-comercialização incluem erupção cutânea, urticária, dispneia, angioedema (por exemplo, inchaço da língua, faringe ou laringe) e casos raros que foram relatados como anafilaxia.
A maioria dos casos não foi grave e ocorreu com a primeira injeção. Embora alguns casos fossem graves e resultassem na descontinuação do tratamento, também houve casos graves em que os pacientes conseguiram continuar o tratamento sem mais incidentes. Alguns sintomas das reações sistêmicas relacionadas à injeção podem ser clinicamente indistinguíveis das reações de hipersensibilidade aguda tipo 1 (mediadas por IgE).
Os pacientes devem ser informados de que as reações sistêmicas relacionadas à injeção geralmente ocorrem dentro de 24 horas e predominantemente após a primeira injeção. As reações sistêmicas relacionadas à injeção podem ser controladas com tratamento sintomático, caso ocorram. Uma reação de hipersensibilidade pode ocorrer com qualquer injeção, embora normalmente não ocorra com a primeira injeção. Para injeções subsequentes, sintomas mais graves do que os anteriores, ou novos sintomas graves, devem levar em consideração uma possível reação de hipersensibilidade. Os doentes com hipersensibilidade conhecida mediada por IgE não devem ser tratados. Foram observados apenas benefícios limitados da pré-medicação com esteroides, anti-histamínicos ou paracetamol nos estudos clínicos em EMR.
Os pacientes tratados com ofatumumabe que receberam pré-medicação com metilprednisolona (ou um esteroide equivalente) apresentaram menos sintomas como febre, mialgia, calafrios e náusea. Entretanto, o uso de pré-medicação com esteroides aumentou a ocorrência de rubor, desconforto torácico, hipertensão, taquicardia e dor abdominal, mesmo na ausência do tratamento com ofatumumabe (ou seja, em pacientes que receberam injeções de placebo). Portanto, o uso de pré-medicação não é necessário.
Contraindicações
Esse medicamento é contraindicado para:
– Paciente com hipersensibilidade à substância ativa ou qualquer componente da fórmula.
– Paciente com infeção por hepatite B ativa.
Fonte:
Kesimpta®. [Bula]. São Paulo: Novartis Biociências S.A. Disponível em: https://consultas.anvisa.gov.br/#/bulario/q/?numeroRegistro=100681176: 22/08/2025
