Nome Comercial/ Apresentação
Rydapt (midostaurina) 25mg / Cápsula mole
Classe Terapêutica
Agentes antineoplásicos, inibidores da proteína quinase.
Indicação
Rydapt é indicado em combinação com a quimioterapia padrão de indução com daunorrubicina e citarabina e de consolidação com citarabina em altas doses, e para pacientes em resposta completa seguida por monoterapia de manutenção com Rydapt, para pacientes adultos com leucemia mieloide aguda (LMA) recém diagnosticada com mutação de FLT3.
Rydapt é indicado como monoterapia para o tratamento de pacientes adultos com mastocitose sistêmica agressiva (MSA), mastocitose sistêmica associada com doença clonal hematopoética de linhagem não mastocitária (MS-ADHNM) ou leucemia das células mastocíticas (LCM).
Dose
LMA
A dose recomendada de Rydapt é de 50 mg por via oral duas vezes ao dia.
Rydapt é administrado nos dias 8 a 21 dos ciclos de quimioterapia de indução e consolidação e, em seguida, para pacientes em resposta completa, a cada dia como monoterapia de manutenção até a recidiva por até 12 ciclos de 28 dias cada. Em pacientes que receberam transplante de células-tronco hematopoiéticas (TCT), Rydapt deve ser descontinuado 48 horas antes do regime de condicionamento para TCT.
MSA, MS-ADHNM e LCM
A dose inicial recomendada de Rydapt é 100 mg por via oral duas vezes ao dia.
O tratamento deve continuar enquanto for observado benefício clínico ou até a ocorrência de toxicidade inaceitável.
Ajuste de dose
Ajustes de dose em LMA
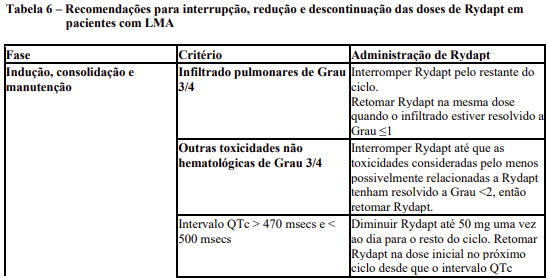
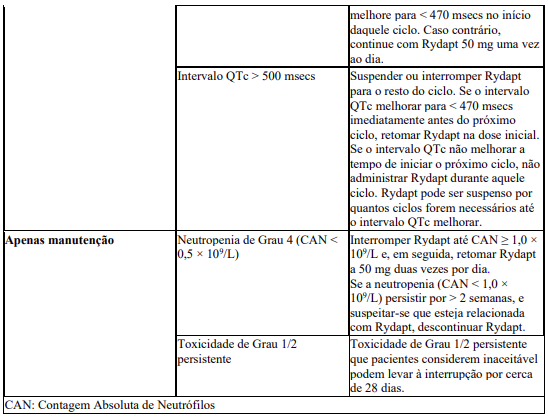
As recomendações para os ajustes da dose de Rydapt em pacientes com LMA são fornecidos na Tabela 6.
Ajustes de dose em MSA, MS-ADHNM e LCM
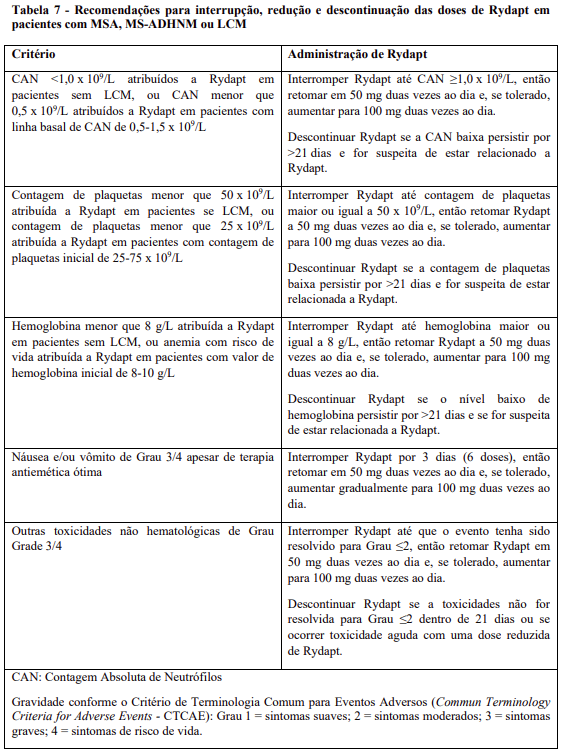
As recomendações para os ajustes da dose de Rydapt em pacientes com MSA, MS-ADHNM e LCM são fornecidos na Tabela 7.
Populações especiais
Idosos (≥ 65 anos)
Nenhum ajuste de dose é necessário para pacientes com idade superior a 65 anos. Há limitada experiência com midostaurina em pacientes com LMA com idade entre 60 e 70 anos e nenhuma experiência com pacientes com LMA acima de 70 anos. Em pacientes com 60 anos ou mais, Rydapt deve ser usado somente por pacientes elegíveis a receber quimioterapia de indução intensiva com estado de desempenho adequado e sem comorbidades significativas.
Insuficiência renal
Nenhum ajuste de dose é necessário para pacientes com insuficiência renal leve ou moderada. A experiência clínica em pacientes com insuficiência renal grave é limitada, e não há dados disponíveis para pacientes com doença renal em fase terminal.
Insuficiência hepática
Nenhum ajuste de dose é necessário para pacientes com insuficiência hepática leve, moderada ou grave (Child-Pugh A, B ou C).
Leucemia promielocítica aguda
Rydapt não foi estudado em pacientes com leucemia promielocítica aguda e, portanto, seu uso não é recomendado para essa população de pacientes.
População pediátrica
A segurança e a eficácia de Rydapt em crianças e adolescentes abaixo de 18 anos não foram estabelecidas. O uso de Rydapt não é recomendado para essa população de pacientes.
Vias de administração
ORAL
Administração
Rydapt deve ser tomado por via oral duas vezes ao dia em intervalos de aproximadamente 12 horas. As cápsulas de Rydapt devem ser engolidas inteiras com um copo de água após as refeições (por exemplo, após o café da manhã e jantar). Rydapt dever ser administrado com uma alimentação com baixo teor de gorduras (alimentação leve).
Antieméticos profiláticos devem ser administrados de acordo com a prática médica local conforme a tolerância do paciente.
Recomenda-se que Rydapt seja administrado com alimentos.
Cuidados específicos e monitoramento
Doses perdidas
Se uma dose for perdida, o paciente deve tomar a próxima dose no horário agendado. Se ocorrer vômito, o paciente não deve tomar outra dose de Rydapt, mas deve tomar a próxima dose agendada.
As avaliações do intervalo de QT por ECG devem ser consideradas se Rydapt for tomado concomitantemente com medicamentos que podem prolongar o intervalo de QT
Interações medicamentosas
Interações medicamentosas e outras formas de interação
A midostaurina passa por um metabolismo hepático extenso, principalmente, através de enzimas CYP3A4 que são induzidas ou inibidas por uma série de medicamentos concomitantes.
Efeitos de outros medicamentos em Rydapt
Medicamentos ou substâncias que afetam a atividade do CYP3A4 podem afetar as concentrações plasmáticas de midostaurina e, portanto, a segurança e/ou eficácia de Rydapt.
Indutores potentes do CYP3A4
A utilização concomitante de Rydapt com indutores potentes de CYP3A4 (por exemplo, carbamazepina, rifampicina, enzalutamida, fenitoína, Erva-de-São-João (Hypericum perforatum)) é contraindicada. Indutores potentes de CYP3A4 diminuem a exposição da midostaurina e dos seus metabólitos ativos (CGP52421 e CGP62221). Em um estudo em indivíduos saudáveis, a co-administração de um potente indutor de CYP3A4 rifampicina (600 mg por dia) no estado de equilíbrio com uma dose única de 50 mg de midostaurina diminuiu a Cmáx de midostaurina em 73% e a AUCinf em 96% em média, respectivamente. CGP62221 apresentou um padrão semelhante. A AUCúltima média de CGP52421 diminuiu em 60%.
Inibidores potentes de CYP3A4
Os inibidores potentes de CYP3A4 podem aumentar as concentrações sanguíneas de midostaurina. Em um estudo com 36 indivíduos saudáveis, a coadministração de um inibidor potente de CYP3A4 cetoconazol no estado de equilíbrio com uma dose única de 50 mg de midostaurina levou a um aumento significativo da exposição à midostaurina (aumento de 1,8 vezes da Cmáx e aumento de 10 vezes na AUCinf) e a um aumento de 3,5 vezes na AUCinf de CGP62221, enquanto que a Cmáx dos metabólitos ativos (CGP62221 e CGP52421) diminuiu para metade. No estado de equilíbrio de midostaurina (50 mg duas vezes ao dia durante 21 dias), com o forte inibidor de CYP3A4 itraconazol no estado de equilíbrio em um subconjunto de pacientes (N = 7), a exposição no estado de equilíbrio de midostaurina (Cmín) aumentou 2,09 vezes. A Cmín de CGP52421 foi aumentada em 1,3 vezes, enquanto nenhum efeito significativo na exposição de CGP62221 foi observado.
Efeito de Rydapt sobre outros medicamentos
Substratos de enzimas CYP Em indivíduos saudáveis, a administração concomitante de uma única dose de bupropiona (substrato do CYP2B6) com múltiplas doses de midostaurina (50 mg duas vezes ao dia) no estado estacionário diminuiu a AUCinf e a AUCúltima da bupropiona em 48% e 49%, respectivamente, e a Cmáx em 55% em comparação à administração única de bupropiona. Isso indica que a midostaurina é um indutor leve de CYP2B6. Os medicamentos com um intervalo terapêutico estreito que são substratos do CYP2B6 devem ser usados com precaução quando administrados concomitantemente com a midostaurina e podem necessitar de ajuste da dose para manter a exposição ideal.
Com base em dados in vitro, a midostaurina e seus metabólitos ativos, CGP52421 e CGP62221, são considerados inibidores do CYP1A2 e CYP2E1 e indutores do CYP1A2. Portanto, os medicamentos com um intervalo terapêutico estreito que são substratos do CYP1A2 e do CYP2E1 devem ser usados com precaução quando administrados concomitantemente com a midostaurina e podem necessitar de ajuste da dose para manter a exposição ideal.
Em indivíduos saudáveis, a co-administração de uma dose única de midazolam (substrato do CYP3A) com múltiplas doses de midostaurina (50 mg duas vezes ao dia) no estado estacionário diminuiu a AUCinf e AUCúltima do midazolam em 3% e 4%, respectivamente, e aumentou a Cmáx em 10% em comparação com a administração de midazolam isoladamente. Portanto, a midostaurina não tem efeito inibitório nem indutor nos substratos do CYP3A.
Em indivíduos saudáveis, a administração concomitante de uma dose única de pioglitazona (substrato do CYP2C8) com doses múltiplas de midostaurina (50 mg duas vezes ao dia) em estado estacionário não causou qualquer diminuição clinicamente significativa na exposição à pioglitazona (redução de 6% na AUCinf e AUCúltimo respectivamente, e redução de 10% na Cmáx) em comparação com a administração de pioglitazona isolada. É improvável que ocorram interações medicamentosas clinicamente relevantes entre a midostaurina e os substratos do CYP2C8.
Em indivíduos saudáveis, a co-administração de uma dose única de dextrometorfano (substrato do CYP2D6) com uma dose única de midostaurina (100 mg) não causou nenhum aumento na exposição ao dextrometorfano (redução de 13% nas AUCs e diminuição de 28% na Cmáx) em comparação com administração de dextrometorfano sozinho. Portanto, a midostaurina não tem efeito inibitório sobre o CYP2D6 e é improvável que ocorram interações medicamentosas clinicamente relevantes entre a midostaurina e os substratos do CYP2D6.
Substratos de transportadores
Em indivíduos saudáveis, a administração concomitante de uma dose única de rosuvastatina (substrato BCRP) com uma dose única de midostaurina (100 mg) aumentou a AUCinf e AUCúltima da rosuvastatina em 37% e 48%, respetivamente; Cmáx foi aproximadamente duplicado (2,01 vezes) em comparação com a administração de rosuvastatina isolada. Isso indica que a midostaurina tem um efeito inibidor moderado sobre os substratos de BCRP. Os medicamentos com uma faixa terapêutica estreita que são substratos do transportador BCRP devem ser usados com cautela quando administrados concomitantemente com a midostaurina, e podem precisar de ajuste da dose para manter a exposição ideal.
Em indivíduos saudáveis, a co-administração de uma dose única de digoxina (substrato da gp-P) com uma dose única de midostaurina (100 mg) aumentou a AUCinf e a AUCúltima da digoxina em 23% e 21%, respectivamente, e a Cmáx em 20% em comparação com a administração de digoxina sozinho. Isso indica que a midostaurina tem um efeito inibitório menor sobre os substratos da gp-P. É improvável que ocorram interações medicamentosas clinicamente relevantes entre a midostaurina e os substratos da gp-P.
Contraceptivos hormonais
Não houve interação farmacocinética medicamentosa clinicamente significativa entre doses múltiplas de midostaurina (50 mg duas vezes ao dia) no estado estacionário e anticoncepcionais orais contendo etinilestradiol e levonorgestrel em mulheres saudáveis. Portanto, não é esperado que a confiabilidade contraceptiva desta combinação seja comprometida pela coadministração de midostaurina.
Interações com alimentos
Em indivíduos saudáveis, a absorção de midostaurina (AUC) aumentou em média 22% quando Rydapt foi coadministrado com uma refeição-padrão e em média 59%, quando coadministrado com uma refeição com elevado teor de gordura. A concentração máxima (Cmáx) de midostaurina foi reduzida em 20% com uma refeição-padrão e em 27% com uma refeição rica em gorduras em comparação com o estômago vazio.
Estabilidade/ Conservação
Conservar o medicamento em temperatura ambiente (entre 15°C e 30°C). Armazenar em sua embalagem original para proteger da umidade.
Reações adversas
Resumo do perfil de segurança
LMA
A avaliação da segurança de Rydapt (50 mg duas vezes por dia) em pacientes com LMA com mutação FLT3 recém diagnosticada se baseia em um estudo de fase III, randomizado, duplo-cego, controlado por placebo, com 717 pacientes. A mediana de duração global de exposição foi de 42 dias (intervalo de 2 a 576 dias) para pacientes no braço de Rydapt associado à quimioterapia padrão versus 34 dias (intervalo de 1 a 465 dias) para pacientes no braço de placebo associado à quimioterapia padrão. Para os 205 pacientes (120 no braço de Rydapt e 85 no braço de placebo) que entraram na fase de manutenção, a mediana de duração de exposição na manutenção foi de 11 meses para ambos os braços (16 a 520 dias para os pacientes no braço de Rydapt e 22 a 381 dias no braço do placebo).
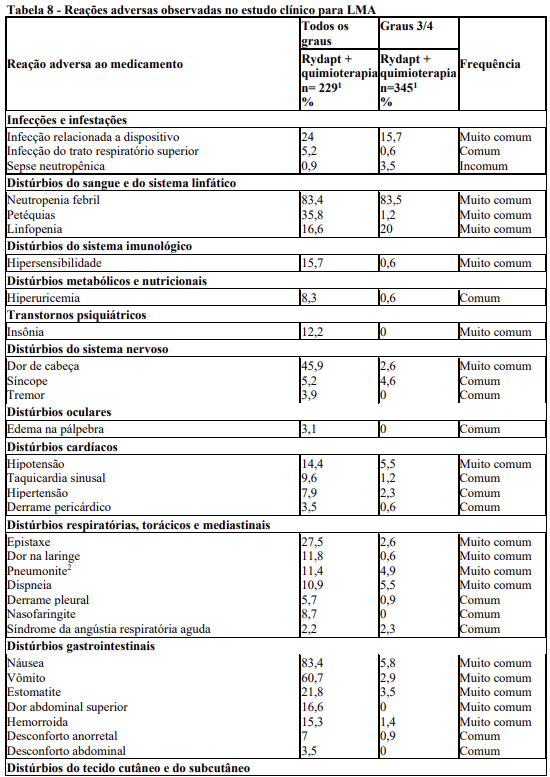
As reações adversas mais frequentes (RAMs) no braço de Rydapt foram neutropenia febril (83,4%), náusea (83,4%), dermatite esfoliativa (61,6%), vômito (60,7%), cefaleia (45,9%), petéquias (35,8%) e pirexia (34,5%). As RAMs mais frequentes de grau 3/4 foram neutropenia febril (83,5%), linfopenia (20,0%), infecção relacionada a dispositivo (15,7%), dermatite esfoliativa (13,6%), hiperglicemia (7,0%) e náusea (5,8%). As anormalidades de laboratório mais frequentes foram diminuição da hemoglobina (97,3%), diminuição CAN (86,7%), aumento de ALT (84,2%), aumento da AST (73,9%) e hipocalemia (61,7%). As anormalidades laboratoriais de Grau 3/4 mais frequentes foram diminuição da CAN (85,8%), diminuição da hemoglobina (78,5%), aumento da ALT (19,4%) e hipocalemia (13,9%).
Eventos adversos graves ocorreram em taxas semelhantes em pacientes no braço de Rydapt versus o braço do placebo. O evento adverso grave mais frequente em ambos os braços foi neutropenia febril (16%).
A descontinuação devido a qualquer reação adversa ocorreu em 3,1% dos pacientes no braço de Rydapt versus 1,3% no braço do placebo. A reação adversa de grau 3/4 mais comum que levou à descontinuação no braço de Rydapt foi dermatite esfoliativa (1,2%).
Perfil de segurança durante a fase de manutenção
Embora a Tabela 8 apresente a incidência de RAMs ao longo da duração total do estudo, quando a fase de manutenção (Rydapt em monoterapia ou placebo) foi avaliada separadamente, observou-se uma diferença no tipo e na severidade das RAMs. A incidência global de RAMs durante a fase de manutenção foi geralmente menor do que nas fases de indução e consolidação. As incidências dos RAMs foram, no entanto, mais elevadas no braço de Rydapt do que no braço placebo durante a fase de manutenção. RAMs ocorreram mais frequentemente no braço de midostaurina do que do placebo durante a manutenção, incluído: náusea (46,4% versus 17,9%), hiperglicemia (20,2% versus 12,5%), vômito (19% versus 5,4%) e prolongamento QT (11,9% versus 5,4%).
A maioria das alterações hematológicas relatadas ocorreu durante as fases de indução e de consolidação, quando os pacientes receberam Rydapt ou placebo em combinação com quimioterapia. As alterações hematológicas mais frequentes de grau 3/4 relatadas em pacientes durante a fase de manutenção com Rydapt foram diminuição da CAN (20,8% versus 18,8%) e leucopenia (7,5% versus 5,9%).
RAMs relatadas durante a fase de manutenção levaram a descontinuações de 1,2% de paciente no braço de Rydapt e nenhum no braço do placebo.
MSA, MS-ADHNM e LCM
A segurança de Rydapt (100 mg duas vezes ao dia) como monoterapia em pacientes com MSA, MSADHNM e LCM foi avaliada em 142 pacientes em 2 estudos de braço único, aberto e multicêntrico. A duração mediana de exposição a Rydapt foi 11,4 meses (intervalo: 0 a 81 meses).
As RAMs mais frequentes foram náusea (82%), vômito (68%), diarreia (51%), edema periférico (35%) e fadiga (31%). As RAMs de Grau 3/4 mais frequentes foram fadiga (8,5%), sepse (7,7%), pneumonia (7%), neutropenia febril (7%) e diarreia (6,3%). As anormalidades laboratoriais não hematológicas mais frequentes são hiperglicemia (93,7%), bilirrubina total aumentada (40,1%), lipase aumentada (39,4%), aspartato aminotransferase aumentada (AST) (33,8%) e alanina aminotransferase aumentada (ALT) (33,1%), enquanto as anormalidades laboratoriais hematológicas mais frequentes foram contagem absoluta de linfócitos diminuída (45,8%), CAN diminuída (26,8%), hiperglicemia (19%) e lipase aumentada (17,6%).
Ajustes de dose (interrupção ou ajuste) devido a RAMs ocorreram em 31% dos pacientes. As RAMs mais frequentes que levaram ao ajuste de dose (incidência≥ 5%) foram náusea e vômito.
As RAMs que levaram à descontinuação do tratamento ocorreram em 9,2% dos pacientes. Os mais frequentes (incidência ≥ 1%) foram neutropenia febril, náusea, vômito e derrame pleural.
Listas tabuladas das reações adversas ao medicamento
As RAMs são listadas de acordo com a classe dos sistemas de órgãos do MedDRA. Dentro de cada classe de sistemas de órgãos, as RAMs são classificadas pela frequência, com as reações mais frequentes em primeiro lugar, utilizando a seguinte convenção: muito comum (≥ 1/10); comum (≥ 1/100, < 1/10); incomuns (≥ 1/1.000 a < 1/100); raras (≥ 1/10.000 a < 1/1.000); muito raras (< 1/10.000); desconhecidas (não podem ser estimadas a partir dos dados disponíveis). Dentro de cada grupo de frequência, as reações adversas estão apresentadas por ordem decrescente de gravidade.
LMA
A Tabela 8 apresenta as categorias de frequência de RAMs relatadas no estudo de fase III em pacientes com LMA recém diagnosticada com mutação FLT3
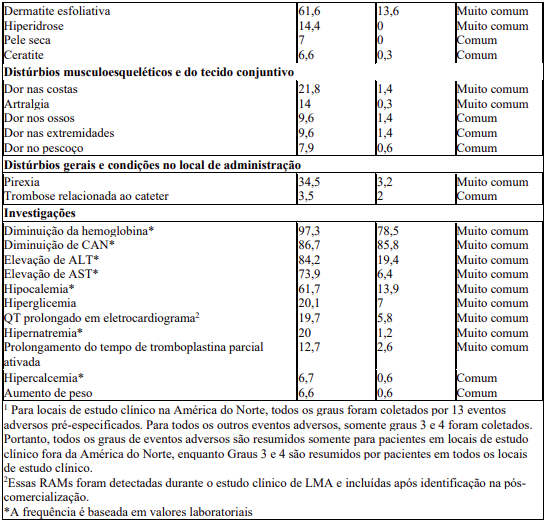
Entre as mortes durante o tratamento, 9 no grupo da midostaurina (2 pacientes: sepse, e 1 paciente cada devido a falência múltipla de órgãos, colite infecciosa, insuficiência respiratória aguda, colite, infarto do miocárdio, sepse neutropênica, hemorragia pulmonar e choque séptico) e 7 pacientes no grupo do placebo (2 pacientes: sepse , 2 pacientes: falência múltipla de órgãos, e 1 paciente cada devido a colite infecciosa, acidente vascular hemorrágico cerebral, hipocalemia e morte súbita) foram suspeitas de estarem relacionadas ao medicamento de estudo.
MSA, MS-ADHNM e LCM
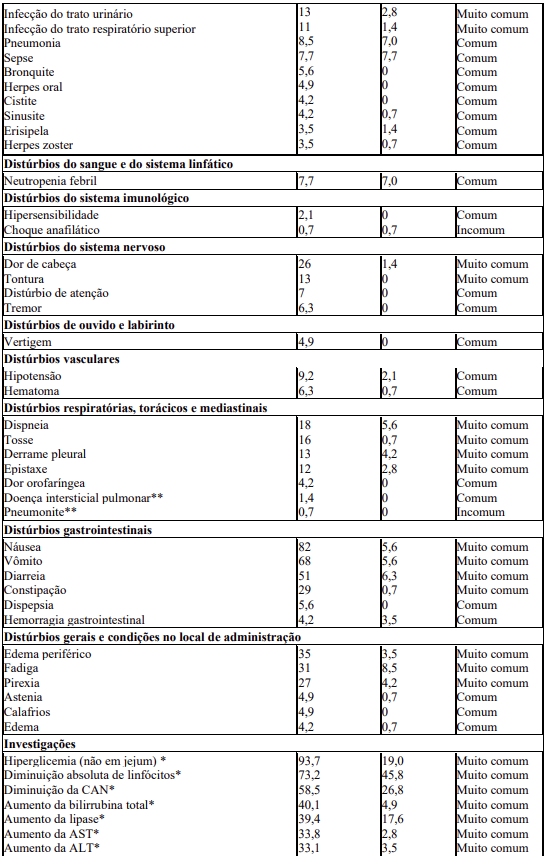
A Tabela 9 apresenta as categorias de frequência de RAMs baseada nos dados agrupados de dois estudos (D2201 e A2213) em pacientes com MSA, MS- ADHNM e LCM.


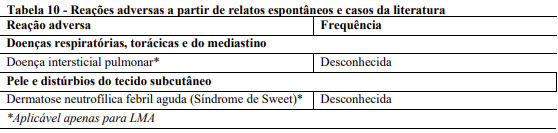
Reações adversas a partir de relatos espontâneos e casos da literatura (frequência desconhecida)
As seguintes reações adversas ao medicamento foram derivadas da experiência pós-comercialização com Rydapt através de relatos de casos espontâneos e casos da literatura. Como essas reações são relatadas voluntariamente por uma população de tamanho incerto, nem sempre é possível estimar com segurança sua frequência.
Descrição das reações adversas a medicamentos selecionados
Problemas gastrointestinais
Náusea, vômito e diarreia foram observados em pacientes com LMA, MSA, MS-ADHNM e LCM. Em paciente com MSA, MS-ADHNM e LCM estes eventos levaram ao ajuste de dose ou interrupção em 26% e a descontinuação em 4,2% dos pacientes. A maioria dos eventos ocorreu dentro dos primeiros 6 meses de tratamento e foram gerenciados com medicamentos profiláticos de suporte.
Contraindicações
Hipersensibilidade à substância ativa ou a qualquer um dos excipientes.
Administração concomitante de potentes indutores de CYP3A4, por exemplo, rifampicina, Erva de São João (Hypericum perforatum), carbamazepina, enzalutamida, fenitoína.
Fonte
Rydapt®. [Bula]. São Paulo: Novartis Biociências S.A. Disponível em: https://consultas.anvisa.gov.br/#/bulario/q/?numeroRegistro=100681156: 14/08/2025
