Nome Comercial/ Apresentação
Gencix (Cloridrato de gencitabina) – pó estéril liofilizado 200mg e 1g.
Evozar (Cloridrato de gencitabina) – pó estéril liofilizado 200mg e 1g.
Classe Terapêutica
Antineoplásico.
Indicação
- Câncer de bexiga, o qual esteja acometendo regiões próximas à bexiga ou metastático (que já tenha se espalhado para outras regiões do corpo).
- Câncer do pâncreas, o qual esteja acometendo regiões próximas ao pâncreas ou metastático (que já esteja acometendo outras regiões do corpo). Também pode ser utilizado para o câncer de pâncreas que não responde a outros tipos de tratamento (5-fluoruracila).
- Câncer de pulmão (do tipo chamado de “câncer de pulmão de não pequenas células”), o qual esteja acometendo regiões próximas ao pulmão ou metastático (que já tenha se espalhado para outras regiões do corpo), em uso isolado ou combinado com cisplatina.
- Câncer de mama irressecável, metastático ou localmente recorrente, que recidivou após quimioterapia adjuvante/neoadjuvante.
Dose
Adulto:
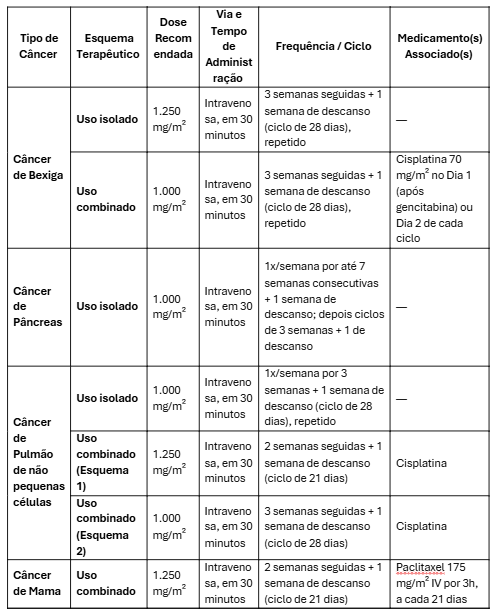
Ajuste de dose
Insuficiência Hepática: bilirrubina sérica >1,6mg/dL, dose inicial de 800mg/m2; escalonar a dose, se tolerado.2
Insuficiência Renal: utilizar com precaução.
Preparo/ Administração
Reconstituir:
200mg: SF 0,9% 5mL. Volume de expansão: 0,26mL
1000mg: SF 0,9% 25mL. Volume de expansão: 1,3mL
Concentração do frasco: 38mg/mL
Diluição:
Endovenosa: Concentração de 0,1 a 10mg/mL
Intravesical: SF 0,9% 50-100mL.
Vias de administração
INTRAVENOSO E INTRAVESICAL
Cuidados específicos e monitoramento
O aumento do tempo de infusão ou da frequência das doses pode elevar a toxicidade. A gencitabina pode causar supressão da medula óssea, manifestada por leucopenia, trombocitopenia e anemia.
Foram relatados casos raros, porém graves, de Síndrome Hemolítico-Urêmica (SHU), Síndrome de Hemorragia Alveolar (SHA), Síndrome do Desconforto Respiratório Agudo (SDRA) e Síndrome de Encefalopatia Posterior Reversível (SEPR), podendo ocorrer com o uso isolado ou em combinação com outros quimioterápicos. Esses eventos podem estar relacionados a lesão do endotélio vascular. A gencitabina deve ser descontinuada imediatamente e instituídas medidas de suporte se qualquer uma dessas condições se desenvolver.
Outros efeitos pulmonares graves, como pneumonite intersticial e edema pulmonar, também foram relatados. Nesses casos, o tratamento deve ser interrompido e o paciente tratado adequadamente.
Monitorização laboratorial:
Devem ser realizados exames de sangue antes de cada dose para avaliação de plaquetas, leucócitos e granulócitos. O tratamento pode ser suspenso ou ajustado em caso de depressão da medula óssea.
A função hepática e renal deve ser monitorada periodicamente. Pacientes com metástases hepáticas ou histórico de hepatite, alcoolismo ou cirrose podem apresentar agravamento da insuficiência hepática.
Carcinogênese, mutagênese e fertilidade:
Não há estudos de longa duração que avaliem o potencial carcinogênico. A gencitabina demonstrou potencial mutagênico e causou hipoespermatogênese reversível em animais machos. Não foram observados efeitos sobre a fertilidade de fêmeas em estudos animais.
Uso em crianças:
A segurança e eficácia da gencitabina em crianças não foram estabelecidas.
Gravidez e amamentação:
Categoria D. A gencitabina pode causar danos ao feto e não deve ser utilizada durante a gravidez ou amamentação. Estudos em animais demonstraram toxicidade reprodutiva. O uso em mulheres grávidas só deve ocorrer sob orientação médica.
Advertência:
Informe imediatamente o médico em caso de suspeita de gravidez.
Efeitos sobre a capacidade de dirigir e operar máquinas: foi relatado que a gencitabina causa sonolência leve a moderada. Os pacientes devem ser alertados para não dirigir ou operar máquinas até que se estabeleça que não estão sonolentos
Interações medicamentosas
O uso da gencitabina associada à radioterapia pode aumentar significativamente a toxicidade, pois o medicamento é radiossensibilizante. A administração simultânea ou em intervalo ≤ 7 dias pode causar reações graves, como mucosite, esofagite e pneumonite, especialmente com altas doses de radiação. O esquema ideal de uso combinado ainda não está definido.
Quando a gencitabina é usada isoladamente, com intervalo maior que 7 dias antes ou após a radioterapia, não há evidência de aumento relevante da toxicidade. Recomenda-se iniciar a gencitabina após a resolução dos efeitos agudos da radioterapia ou pelo menos uma semana após seu término.
Foram relatadas lesões induzidas por radiação em tecidos-alvo com o uso isolado ou combinado da gencitabina.
Não há dados sobre interações com fitoterápicos, nicotina ou comorbidades. Como é administrada por via intravenosa, não há interação com alimentos.
Estabilidade/ Conservação
Deve ser armazenado em temperatura ambiente (15 a 30ºC). Proteger da luz. Não refrigerar. As soluções reconstituídas de gencitabina podem ser mantidas em temperatura ambiente (15 a 30ºC) e devem ser administradas dentro de 24 horas.
Após preparo, manter em temperatura ambiente (15 a 30ºC) por até 24 horas.
Reações adversas
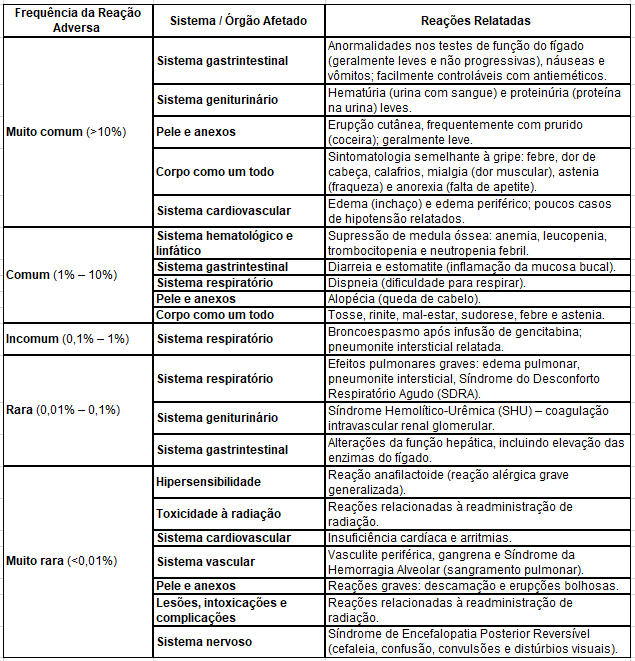
Contraindicações
É contraindicado àqueles pacientes com hipersensibilidade conhecida à gencitabina ou a qualquer um dos excipientes presentes na fórmula.
