Nome Comercial/ Apresentação
Cellcept (micofenolato de mofetila) 500mg / Comprimidos revestidos
Classe Terapêutica
Imunossupressor
Indicação
Em associação com ciclosporina A e corticosteroide está indicado para:
● Profilaxia da rejeição aguda de órgãos e para o tratamento da primeira rejeição ou da rejeição refratária de órgãos em pacientes adultos receptores de transplantes renais alogênicos.
● Profilaxia da rejeição aguda de órgãos, em pacientes adultos receptores de transplante cardíaco alogênico. Na população tratada, o MMF aumentou a sobrevida no primeiro ano após o transplante.
● Profilaxia da rejeição aguda de órgãos em pacientes adultos receptores de transplante hepático alogênico.
Cellcept® está indicado para terapia de indução e manutenção de pacientes adultos com nefrite lúpica classe III à V, diagnosticados de acordo com a classificação da Sociedade Internacional de Nefrologia / Sociedade de Patologia Renal.
Dose
Pacientes transplantados
Deve ser administrado todos os dias. É importante manter a rotina de uso para garantir que o órgão transplantado continue funcionando adequadamente.
Dosagem padrão para profilaxia da rejeição renal
A dose de 1,0 g administrada duas vezes ao dia (dose diária de 2 g) é recomendada em pacientes de transplante renal. Apesar de a dose de 1,5 g duas vezes ao dia (dose diária de 3 g) ter sido usada em estudos clínicos e ter se mostrado efetiva e segura, não mostrou vantagem em termos de eficácia para pacientes de transplante renal. Pacientes recebendo 2g/dia demonstraram um perfil de segurança geral melhor quando comparados aos pacientes que receberam 3 g/dia.
Dosagem padrão para profilaxia da rejeição cardíaca
A dose de 1,5 g administrada duas vezes ao dia (dose diária de 3 g) é recomendada a pacientes submetidos a transplante cardíaco.
Dosagem padrão para profilaxia da rejeição hepática
A dose de 1,5 g administrada duas vezes ao dia (dose diária de 3 g) é recomendada a pacientes submetidos a transplante hepático.
Dosagem para o tratamento da primeira rejeição e da rejeição refratária renal
A dose de 1,5 g administrada duas vezes ao dia (dose diária de 3 g) é recomendada para o tratamento da primeira rejeição e da rejeição refratária.
Administração oral
A dose inicial deve ser administrada o mais breve possível após o transplante renal, cardíaco ou hepático.
Pacientes adultos com nefrite lúpica
Dosagem padrão para terapia de indução
A dose de 750 mg a 1,5 g administrada duas vezes ao dia (dose diária de 3 g) é recomendada a pacientes adultos com nefrite lúpica.
Dosagem padrão para terapia de manutenção
A dose de 500mg a 1g administrada duas vezes ao dia é recomendada a pacientes adultos com nefrite lúpica.
Deve ser utilizado em combinação com corticosteroides. As doses devem ser introduzidas gradualmente e ajustadas de acordo com a resposta clínica. O monitoramento da terapia com o medicamento pode prevenir a exposição sub-terapêutica (Cmín ≥ 3,0 mg/L ou AUC ≥35 h*mg/L interdose).
Ajuste de dose
Pacientes com neutropenia
Para pacientes que desenvolvem neutropenia (contagem absoluta de neutrófilos < 1,3 x 103 /mL), o tratamento deve ser interrompido ou a dose deve ser reduzida.
Disfunção renal grave
Para pacientes transplantados renais com disfunção renal crônica grave (taxa de filtração glomerular < 25 mL/min/1,73 m2), fora do período imediatamente após o transplante ou após o tratamento da rejeição aguda ou refratária, doses maiores que 1g administradas duas vezes ao dia devem ser evitadas. Para pacientes que apresentam retardo na função do enxerto renal após a cirurgia do transplante, não é recomendado ajuste de dose, mas os pacientes devem ser cuidadosamente monitorados. Para pacientes com disfunção renal grave que receberam transplante cardíaco ou hepático, não existem dados disponíveis.
Para pacientes com nefrite lúpica com taxa de filtração glomerular < 30 mL/min, o monitoramento do medicamento é recomendado.
Disfunção hepática grave
Para pacientes de transplante renal com doença grave no parênquima hepático, nenhum ajuste de dose é recomendado. Para pacientes que receberam transplante cardíaco com doença grave do parênquima hepático, não existem dados disponíveis.
Uso geriátrico (> 65 anos)
Para pacientes transplantados, não é recomendado nenhum ajuste de dose. Para pacientes com nefrite lúpica, não há recomendação disponível.
Vias de administração
ORAL
Administração
O comprimido deve ser ingerido com um pouco de água.
Este medicamento não deve ser partido ou mastigado.
Cuidados específicos e monitoramento
Como mostrou ter efeito teratogênico, seus comprimidos não devem ser triturados para evitar inalação ou contato direto com a pele ou mucosa. Em caso de contato com a pele ou membranas mucosas, lavar minuciosamente com água e sabão.
Em casos de contato com os olhos, limpar com água corrente.
Interações medicamentosas
Inibidores da DNA Polimerase (aciclovir, ganciclovir)
Aciclovir: concentrações plasmáticas maiores de aciclovir e MPAG foram observadas quando foi administrado com aciclovir em comparação com a administração de cada droga isoladamente. Devido ao aumento da concentração plasmática de MPAG na presença de disfunção renal, como ocorre com o aciclovir, pode ocorrer competição entre o micofenolato de mofetila e o aciclovir ou seus pró-fármacos como o valganciclovir pela secreção tubular e isso pode aumentar as concentrações de ambas as drogas.
Ganciclovir: baseado nos resultados de um estudo com administração de dose única, nas doses recomendadas de CellCept® oral e ganciclovir intravenoso e nos efeitos conhecidos da deterioração renal sobre a farmacocinética do MMF e do ganciclovir, prevê-se que a co-administração desses agentes (que competem pelos mecanismos de secreção tubular renal) resultará em aumento na concentração do MPAG e do ganciclovir. Nenhuma alteração substancial na farmacocinética do MPA é prevista, não sendo necessário o ajuste da dose do MMF. Pacientes com deterioração renal nos quais o MMF e o ganciclovir ou seus pró-fármacos, como o valganciclovir, são co-administrados, devem ser monitorados cuidadosamente.
Antiácidos e inibidores da bomba de prótons (IBPs)
Exposição diminuída de ácido micofenólico (MPA) foi observada quando antiácidos, como hidróxidos de alumínio e magnésio, e IBPs, incluindo omeprazol, lansoprazol e pantoprazol, foram administrados com CellCept®. Não foram observadas diferenças significativas ao comparar as taxas de rejeição de transplante ou as taxas de perda do enxerto entre pacientes de CellCept® que utilizaram IBPs versus pacientes de CellCept® que não utilizaram IBPs. Esses dados suportam a extrapolação dessa observação para todos os antiácidos, pois a redução à exposição é consideravelmente menor quando CellCept® foi coadministrado com hidróxidos de alumínio e magnésio em relação à coadministração com IBPs.
Sequestrantes
Colestiramina: após administração de 1,5g de CellCept® em indivíduos saudáveis pré-tratados com colestiramina 4g, três vezes ao dia durante quatro dias, houve redução de 40% na AUC do MPA. Deve-se ter cautela durante a administração concomitante de drogas que interfiram na circulação entero-hepática.
Sevelâmer: a administração concomitante de sevelâmer e CellCept®, em pacientes adultos, diminuiu a Cmáx e a AUC0- 12 do MPA em 30% e 25%, respectivamente.
Imunossupressores
Ciclosporina A: a farmacocinética da ciclosporina A (CsA) não é afetada por CellCept®. Entretanto, CsA interfere na circulação entero-hepática do MPA, resultando em reduções de 30% a 50% na exposição do MPA em pacientes transplantados renais tratados com CellCept® e CsA, se comparado com pacientes que receberam sirolimo ou belatacept e doses semelhantes de CellCept®. Inversamente, mudanças na exposição de MPA devem ser esperadas quando há substituição do uso de CsA para um dos imunossupressores que não interferem na circulação entero-hepática do MPA.
Tacrolimo: não foi observado efeito na AUC ou Cmáx do MPA em pacientes transplantados hepáticos, ao administrar tacrolimo concomitantemente com CellCept®. Observou-se resultado similar em um estudo recente, em pacientes transplantados renais. Em pacientes transplantados renais, mostrou-se que a concentração do tacrolimo parece não ser alterada pelo CellCept®. Entretanto, em pacientes transplantados hepáticos estáveis, observou-se aumento de aproximadamente 20% na AUC do tacrolimo, quando foram administradas doses múltiplas de CellCept® (1,5 g duas vezes ao dia) para pacientes recebendo tacrolimo.
Antibióticos
Rifampicina: após correção da dose, uma diminuição em 70% da exposição de MPA (AUC0-12h) foi observada com administração concomitante de rifampicina em um único paciente transplantado de coração e pulmão. Portanto, recomenda-se controlar os níveis de exposição de MPA e ajustar as doses de CellCept® para manter a eficácia clínica quando as drogas são administradas concomitantemente.
Antibióticos eliminadores de bactérias intestinais produtoras de β-glucuronidase (por exemplo, aminoglicosídeos, cefalosporinas, fluoroquinolona, e antibióticos penicilínicos) podem interferir na recirculação entero-hepática, o que acarreta na redução da exposição sistêmica de MPA.
Informações acerca dos seguintes antibióticos estão disponíveis:
Ciprofloxacino ou amoxicilina associada ao ácido clavulânico: reduções de 54% nas concentrações pré-tomada (vale) de MPA foram relatadas em pacientes transplantados renais nos dias imediatamente após o início da ciprofloxacino oral ou amoxicilina associada ao ácido clavulânico. Os efeitos tendem a diminuir com o uso continuado do antibiótico e a cessar após a descontinuação. A alteração no nível de pré-dose pode não representar exatamente as alterações na exposição global ao MPA, portanto, a relevância clínica dessas observações é incerta.
Norfloxacino e metronidazol: norfloxacino em combinação com metronidazol diminuiu a AUC0-48 do MPA em 30%, após dose única de CellCept®. Esse efeito sobre a exposição sistêmica de MPA não ocorreu com qualquer um destes antibióticos quando foram administradas separadamente.
Trimetoprima/ sulfametoxazol: Não foi observado efeito sobre a exposição sistêmica do MPA (AUC, Cmáx) com a combinação trimetoprima / sulfametoxazol.
Contraceptivos orais
Um estudo de coadministração de CellCept® (1 g duas vezes ao dia) e contraceptivo oral combinado contendo etinilestradiol (0,02 – 0,04 mg) e levonorgestrel (0,05 – 0,20 mg), desogestrel (0,15 mg) ou gestodeno (0,05 – 0,10 mg) envolvendo 18 mulheres com psoríase e conduzido por mais de três ciclos menstruais não mostrou influência clínica relevante de CellCept® nos níveis séricos da progesterona, do LH e do FSH, não indicando, portanto, influência de CellCept® no efeito supressor da ovulação dos contraceptivos orais. A farmacocinética dos contraceptivos orais não foi afetada em um nível clinicamente relevante pela co-administração de CellCept®.
Outras interações
A administração concomitante de drogas que inibem a glucoronidação de ácido micofenólico (MPA) pode aumentar a exposição de MPA (por exemplo, foi observado aumento na AUC0-∞ de MPA em 35% com administração concomitante de isavuconazol). Deve-se ter cautela durante a administração concomitante dessas drogas com CellCept®.
A administração concomitante de telmisartana e CellCept® resultou em uma diminuição de aproximadamente 30% nas concentrações de ácido micofenólico (MPA). Telmisartana altera a eliminação do MPA por aumentar a expressão de PPAR gama (receptor gama ativador da proliferação de peroxissoma), que por sua vez resulta no aumento da expressão e da atividade de UGT1A9, aumentando a glucuronidação. Ao comparar as taxas de rejeição do transplante, as taxas de perda do enxerto ou perfis de eventos adversos entre os pacientes de CellCept® com e sem uso concomitante de telmisartana, não foram observadas consequências clínicas da interação medicamentosa farmacocinética.
Coadministração de probenecida com CellCept® em macacos aumenta, em três vezes, a AUC plasmática do MPAG. Portanto, outras drogas que sofrem secreção tubular renal podem competir com o MPAG e aumentar a concentração plasmática de ambas.
Vacinas de vírus vivos: vacinas de vírus vivos não devem ser administradas a pacientes com alteração da resposta imune. A resposta de anticorpos a outras vacinas pode estar diminuída.
Estabilidade/ Conservação
CellCept® deve ser mantido em sua embalagem original. Os comprimidos devem ser conservados em temperatura ambiente (entre 15º e 30º C) e protegidos contra a umidade.
Reações adversas
O perfil de segurança apresentado neste item é baseado em dados de estudos clínicos e experiência pós-comercialização e demonstram ser consistentes nas populações de pacientes transplantados e com nefrite lúpica.
Experiência de estudos clínicos
Um total estimado de 1.557 pacientes receberam CellCept® durante os estudos clínicos pivotais na prevenção da rejeição aguda de órgãos. Destes, 991 foram incluídos nos estudos renais combinados ICM1866, MYC022, MYC023, 277 foram incluídos no estudo hepático MYC2646 e 289 foram incluídos no estudo cardíaco MYC1864. Os pacientes em todos os braços do estudo receberam também ciclosporina e corticosteroides.
Nos estudos pivotais, diarreia, leucopenia, sepse e vômitos estavam entre as reações adversas mais comuns e / ou graves relacionadas ao uso de CellCept®. Houve também evidência de maior frequência de certos tipos de infecção, como por exemplo infecções oportunistas.
Nos três estudos pivotais para prevenção da rejeição em transplante renal, os pacientes que receberam CellCept® 2 g/dia apresentaram um perfil de segurança geral melhor que os que receberam 3 g/dia. O perfil de segurança de CellCept® em pacientes tratados para rejeição refratária em transplante renal foi semelhante àquele observado nos estudos pivotais para prevenção de rejeição renal com doses de 3 g por dia. Diarreia e leucopenia, seguidas de anemia, náuseas, dor abdominal, sepse, náuseas, vômitos e dispepsia foram os eventos adversos relatados com maior frequência pelos pacientes recebendo CellCept® em comparação com pacientes recebendo corticosteroide intravenoso.
Resumo tabelado de reações adversas dos estudos clínicos
As reações adversas dos estudos clínicos (Tabela 1) estão listadas conforme sistema MedDRA de classes de órgãos, juntamente com a suas incidências. A categoria de frequência correspondente para cada reação adversa é baseada na seguinte convenção: muito comum (≥1 / 10); comum (≥1 / 100 a <1/10); incomum (≥1 / 1.000 a <1/100); rara (≥1 / 10.000 a <1 / 1.000); muito rara (<1 / 10.000). Devido às grandes diferenças observadas na frequência de certas reações adversas a medicamento (RAMs) nas diferentes indicações de transplante, a frequência é apresentada separadamente para os pacientes com transplante renal, hepático e cardíaco.
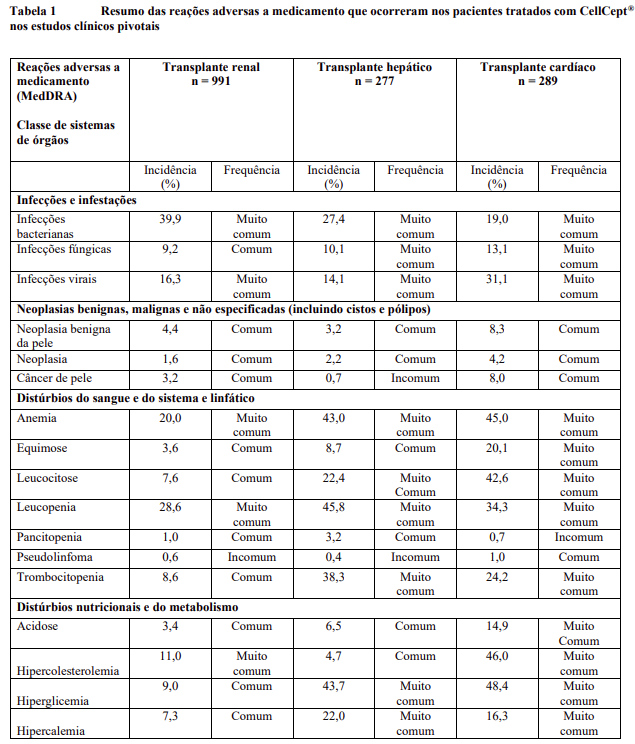
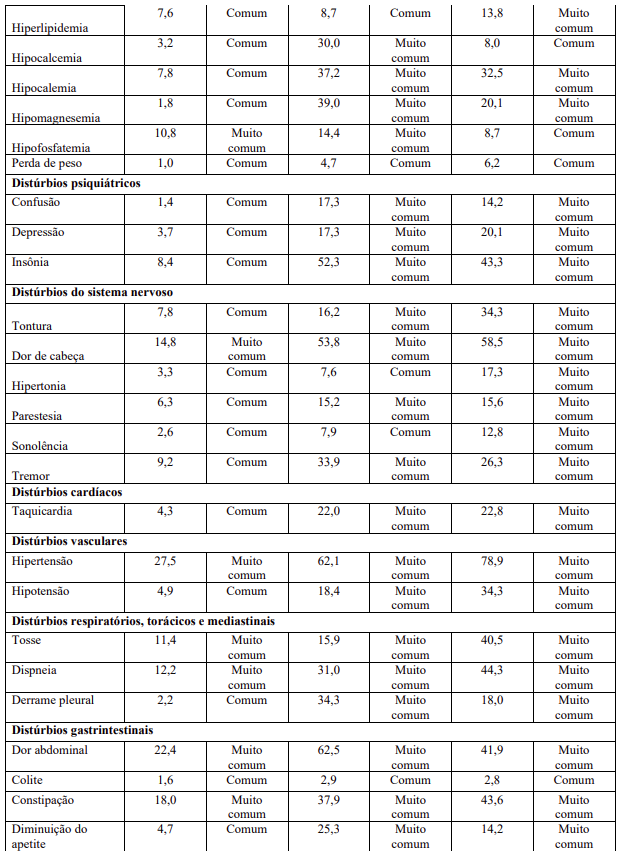
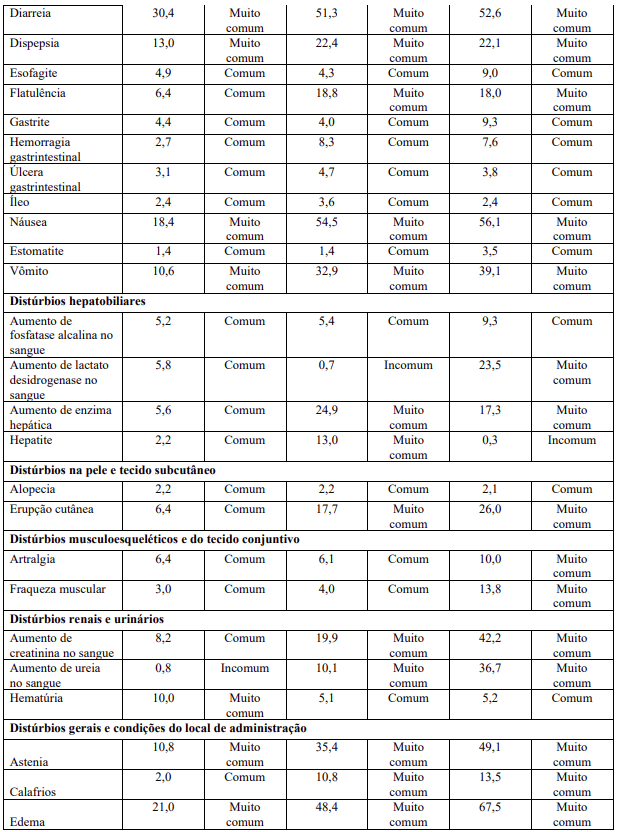
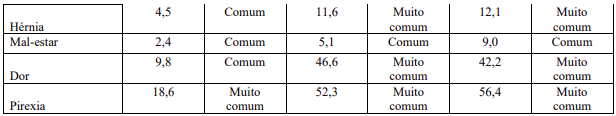
Descrição de reações adversas selecionadas
Infecções
Todos os pacientes tratados com imunossupressores têm maior risco de desenvolver infecções bacterianas, virais e fúngicas (alguns dos quais podem levar a um desfecho fatal), incluindo aquelas causadas por agentes oportunistas e reativação viral latente. O risco aumenta com a intensidade da imunossupressão.
As infecções mais graves foram sepse e peritonite. As infecções oportunistas mais comuns em pacientes em uso de CellCept® com outros imunossupressores foram candidíase mucocutânea, síndrome/viremia por CMV e herpes simples.
A proporção de pacientes com síndrome/viremia por CMV foi de 13,5%.
Neoplasias
Os pacientes tratados com CellCept® como parte de um regime imunossupressor têm maior risco de desenvolver linfomas e outras neoplasias, particularmente de pele.
Dados de segurança de três anos em pacientes de transplante renal e cardíaco não revelaram qualquer alteração inesperada na incidência de neoplasias, comparados com os dados de um ano. Pacientes receptores de transplante hepático foram acompanhados por pelo menos um ano, mas por menos que três anos.
Em estudos clínicos de suporte para o tratamento da rejeição refratária em transplante renal, a taxa de linfomas foi de 3,9% em um seguimento médio de 42 meses.
Distúrbios do sangue e do sistema linfático
Citopenias, incluindo leucopenia, anemia, trombocitopenia e pancitopenia, são um risco conhecido associado ao micofenolato e podem levar ou contribuir para a ocorrência de infecções e hemorragias.
Gastrintestinal
Os distúrbios gastrintestinais mais graves foram ulceração e hemorragia, que são riscos conhecidos associados ao CellCept®. Úlceras orais, esofágicas, gástricas, duodenais e intestinais frequentemente complicadas por hemorragia, bem como hematêmese, melena e formas hemorrágicas de gastrite e colite foram comumente relatadas durante os estudos clínicos pivotais. Os distúrbios gastrintestinais mais comuns, no entanto, foram diarreia, náusea e vômito. A investigação endoscópica de pacientes com diarreia relacionada ao CellCept® revelou casos isolados de atrofia das vilosidades intestinais.
Distúrbios gerais e condições do local de administração
Edema, incluindo edema periférico, facial e escrotal, foi relatado muito frequentemente durante os estudos pivotais. Dor musculoesquelética, como mialgia e dor no pescoço e nas costas, também foram muito comumente relatadas.
Populações especiais
População geriátrica (≥ 65 anos)
Pacientes geriátricos, particularmente aqueles que recebem CellCept® como parte de um regime imunossupressor combinado, podem ter maior risco de certas infecções (incluindo doença invasiva de tecido por citomegalovírus) e possivelmente hemorragia gastrintestinal e edema pulmonar, quando comparados com pacientes jovens.
Experiência pós-comercialização
As reações adversas na Tabela 2 estão listadas de acordo com a classe de sistema de órgãos MedDRA e a estimativa da categoria de frequência correspondente para cada reação adversa ao medicamento baseia-se na seguinte convenção: muito comum (≥1 / 10); comum (≥1 / 100 a <1/10); incomum (≥1 / 1.000 a <1/100); rara (≥1 / 10.000 a <1 / 1.000); muito rara (<1 / 10.000).
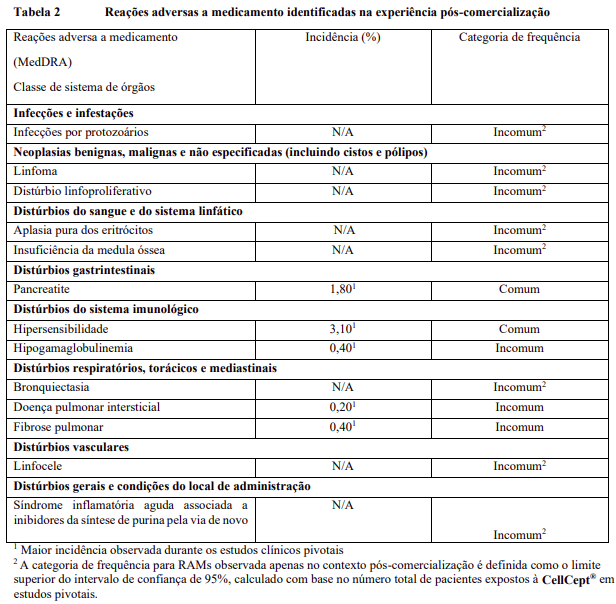
Infecções: Infecções com risco de morte, como meningite e endocardite infecciosa, foram relatadas ocasionalmente, existindo evidência de maior frequência de determinados tipos de infecções, como tuberculose e infecção por micobactérias atípicas.
Leucoencefalopatia multifocal progressiva (LMP) e nefropatia associada ao vírus BK, foram relatadas em pacientes tratados com CellCept®.
Doenças congênitas e gravidez, puerpério e condições perinatais
Distúrbios gerais e condições do local de administração
A síndrome inflamatória aguda associada aos inibidores da síntese de purinas de novo é uma reação pró-inflamatória paradoxal recém-descrita associada ao micofenolato e outros inibidores da síntese de purinas, caracterizada por febre, artralgias, artrite, dor muscular e marcadores inflamatórios elevados. Relatórios anedóticos da literatura mostraram melhorias rápidas após a descontinuação do medicamento.
Contraindicações
Foram observadas reações alérgicas a CellCept®. Portanto, CellCept® está contraindicado a pacientes com hipersensibilidade conhecida ao micofenolato de mofetila ou ao ácido micofenólico.
Gestação e lactação
Categoria de risco na gravidez: X. Este medicamento não deve ser utilizado por mulheres grávidas ou que possam ficar grávidas durante o tratamento.
CellCept® é contraindicado durante a gravidez devido ao seu potencial teratogênico e mutagênico.
CellCept® é contraindicado para mulheres em idade fértil que não estão utilizando métodos contraceptivos altamente efetivos.
CellCept® é contraindicado para mulheres que estão amamentando.
Não há contraindicação relativa às faixas etárias.
Fonte:
Cellcept®. [Bula]. São Paulo: Produtos Roche Químicos e Farmacêuticos S.A. Disponível em: https://consultas.anvisa.gov.br/#/bulario/q/?numeroRegistro=101000539: 14/08/2025
