Nome Comercial e Princípio Ativo / Apresentação:
Avastin / Bevacizumabe – Solução injetável 25 mg/mL 4 mL e 16 mL
Classe Terapêutica: ANTINEOPLASICO
Indicação:
Câncer colorretal metastático (CCRm); Câncer de pulmão de não pequenas células localmente avançado, metastático ou recorrente; Câncer de mama metastático ou localmente recorrente (CMM); Câncer de células renais metastático e / ou avançado (mRCC); Câncer epitelial de ovário, tuba uterina e peritoneal primário; Câncer de colo do útero
Dose:
Para informações mais detalhadas, vide bula do medicamento.
Câncer colorretal metastático (CCRm);
Tratamento de primeira linha Quando administrado em combinação com 5-fluorouracil/leucovorin; 5-fluorouracil/leucovorin e irinotecano ou 5- fluoracil/leucovorin e oxaliplatina, a dose recomendada de Avastin® é de 5 mg/kg de peso corporal administrada uma vez a cada 2 semanas – contínuo até progressão da doença de base ou toxicidade inaceitável.
Tratamento de segunda linha sem utilização prévia de Avastin® Quando administrado em combinação com 5-fluorouracil e leucovorin, seguido de 5-fluorouracil com oxaliplatina, a dose recomendada de Avastin® é de 10 mg/kg de peso corporal administrada uma vez a cada 2 semanas ou 15 mg/kg de peso corporal administrada uma vez a cada 3 semanas – contínuo até progressão da doença de base ou toxicidade inaceitável.
Tratamento de segunda linha com utilização prévia de Avastin® Quando administrado em combinação com fluoropirimidina/irinotecano ou fluoropirimidina/oxaliplatina, a dose recomendada de Avastin® é de 5 mg/kg de peso corporal administrada uma vez a cada 2 semanas ou 7,5 mg/kg de peso corporal administrada uma vez a cada 3 semanas – contínuo até progressão da doença de base ou toxicidade inaceitável.
Câncer de pulmão de não pequenas células localmente avançado, metastático ou recorrente
Tratamento de primeira linha de câncer de pulmão de não pequenas células em combinação com quimioterapia à base de platina
Avastin® é administrado em combinação com quimioterapia à base de platina, em até seis ciclos de tratamento seguidos de Avastin® em monoterapia até progressão da doença. A dose recomendada de Avastin®, quando usado em associação com quimioterapia à base de cisplatina, é de 7,5 mg/kg de peso corporal administrada uma vez a cada três semanas, por infusão intravenosa. A dose recomendada de Avastin®, quando usado em associação com quimioterapia à base de carboplatina, é de 15 mg/kg de peso corporal administrada uma vez a cada três semanas, por infusão intravenosa. – Recomenda-se que mantenha uso contínuo até progressão da doença de base ou toxicidade inaceitável.
Tratamento de primeira linha de câncer de pulmão de não pequenas células com mutações ativadoras de EGFR em combinação com erlotinibe
A dose recomendada de Avastin®, quando usado em associação com erlotinibe, é de 15 mg/kg de peso corporal administrada uma vez a cada três semanas, por infusão intravenosa.
Recomenda-se que mantenha uso contínuo em associação com erlotinibe até progressão da doença de base ou toxicidade inaceitável.
Câncer de mama metastático ou localmente recorrente (CMM);
A dose recomendada de Avastin® é de 10 mg/kg de peso corporal administrada a cada duas semanas ou de 15 mg/kg de peso corporal administrada a cada três semanas, por infusão intravenosa. – Recomenda-se que mantenha uso contínuo até progressão da doença de base ou toxicidade inaceitável.
Câncer de células renais metastático e / ou avançado (mRCC);
A dose recomendada de Avastin® é de 10 mg/kg de peso corporal administrada a cada duas semanas, por infusão intravenosa. – Recomenda-se que mantenha uso contínuo até progressão da doença de base ou toxicidade inaceitável.
Câncer epitelial de ovário, tuba uterina e peritoneal primário;
Tratamento em primeira linha: 15 mg/kg de peso, uma vez a cada três semanas, em associação a carboplatina e paclitaxel por até seis ciclos de tratamento, seguido pelo uso continuado de Avastin® em monoterapia por 15 meses ou até progressão da doença ou toxicidade inaceitável, o que ocorrer primeiro.
Tratamento da doença recorrente platino sensível: 15 mg/kg de peso, uma vez a cada três semanas, em combinação com carboplatina paclitaxel por 6 ciclos e até 8 ciclos seguido pelo uso continuado de Avastin®, em monoterapia até a progressão da doença.
Alternativamente 15 mg/kg a cada 3 semanas quando administrado em combinação com carboplatina e gencitabina por seis ciclos (até o máximo dez ciclos), seguidos do uso contínuo de Avastin® como agente único até a progressão da doença.
Tratamento da doença recorrente platino resistente: 10 mg/kg de peso, uma vez a cada duas semanas, em associação a um dos seguintes agentes: paclitaxel e topotecana (administrados semanalmente) ou doxorrubicina lipossomal peguilada. Como alternativa, 15 mg/kg de peso a cada três semanas em associação a topotecana administrada nos Dias 1-5, a cada três semanas – Recomenda-se que mantenha uso contínuo até progressão da doença de base ou toxicidade inaceitável.
Câncer de colo do útero
Avastin® é administrado em associação a um dos seguintes regimes quimioterápicos: paclitaxel e cisplatina ou paclitaxel e topotecana. A dose recomendada de Avastin® é 15 mg/kg de peso corporal, administrada uma vez a cada três semanas por infusão intravenosa. – Recomenda-se que mantenha uso contínuo até progressão da doença de base ou toxicidade inaceitável.
Dose Máxima:
A maior dose testada no ser humano (20 mg/kg de peso corpóreo, intravenosa, a cada duas semanas) foi associada com enxaqueca intensa em vários pacientes.
Ajuste de dose:
Uso pediátrico: Avastin® não é aprovado para uso em pacientes abaixo de 18 anos.
Insuficiência renal ou hepática: A eficácia e a segurança de Avastin® em pacientes com insuficiência renal ou hepática não foram estudadas.
Uso geriátrico: não há recomendações especiais de doses para idosos com idade acima de 65 anos, porém para pacientes acima de 65 anos o uso de Avastin® está associado a risco aumentado de problemas vasculares arteriais,
Vias de administração:
Infusão intravenosa
Preparo:
Utilize seringa e agulha estéreis para o preparo de Avastin®.
Dispositivos de transferência de sistema fechado (closed system transfer devices – CSTD) não são recomendados para a preparação de Avastin®.
Retire a quantidade necessária de bevacizumabe e dilua em um volume necessário para administração com 0,9% de uma solução de cloreto de sódio. A faixa de concentração da solução de bevacizumabe final deve ser mantida entre 1,4 e 16,5 mg/mL.
Despreze qualquer quantidade deixada no frasco-ampola, pois este medicamento não contém conservantes.
Administração:
Não administrar em injeção intravenosa direta ou em bolus.
A dose inicial de Avastin® deve ser administrada em 90 minutos, em infusão intravenosa.
Se a primeira infusão for bem tolerada, a segunda infusão pode ser administrada durante 60 minutos.
Se a infusão em 60 minutos for bem tolerada, todas as infusões subsequentes podem ser administradas em 30 minutos.
Cuidados e orientações:
A velocidade de infusão recomendada não deve ser excedida
Em caso de suspeita de dengue, ou quando associado a outros medicamentos que aumentem o efeito hemorrágico, a prescrição deste medicamento ou a manutenção do tratamento com ele deve ser reavaliada, devido a seu potencial hemorrágico
Categoria de risco na gravidez: C. Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica ou do cirurgião-dentista.
Interações Medicamentosas:
Bevacizumabe e maleato de Sunitinibe: Em dois estudos clínicos de carcinoma de células renais metastático, foi relatada anemia hemolítica microangiopática (AHMA) em sete dos 19 pacientes tratados com bevacizumabe (10 mg/kg a cada duas semanas) em combinação com maleato de sunitinibe (50 mg por dia).
Estabilidade/ Conservação: Avastin® não contém nenhum conservante antimicrobiano; portanto, depois de aberto, deve-se tomar cuidado para garantir a esterilidade da solução preparada. Depois de misturado com soro fisiológico para administração, o produto deve ser utilizado imediatamente.
Não congelar e não agitar.
Contraindicações: Avastin® deve ser descontinuado em pacientes com eventos tromboembólicos venosos grau 4 (risco de morte), incluindo embolia pulmonar. Pacientes com eventos tromboembólicos venosos grau ≤ 3 necessitam de monitoramento rigoroso.
Reações adversas:
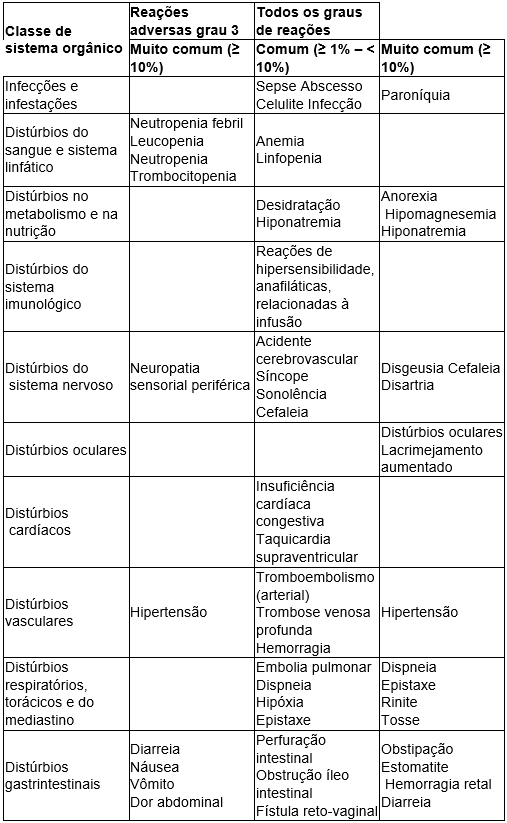
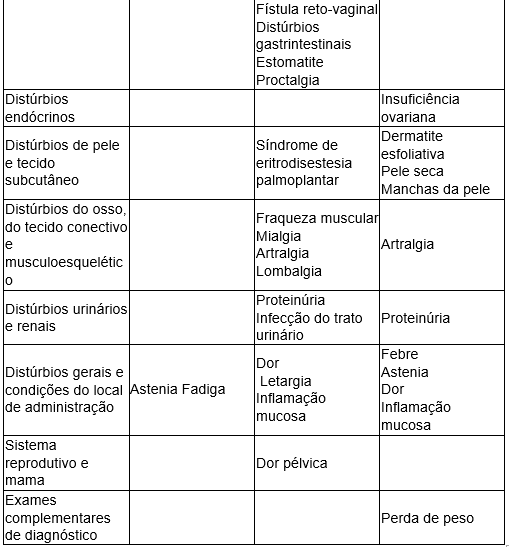
Fonte: Bendamustina. [Bula]. São Paulo: Teva Farmacêutica Ltda. Disponível em: https://consultas.anvisa.gov.br/#/bulario/q/?nomeProduto=AVASTIN Acesso em 25/10/2025.
