Nome Comercial/ Apresentação
Skyrizi (risanquizumabe) 75mg/0,83mL / Seringas prontas
Skyrizi (risanquizumabe) 150mg/mL / Seringas prontas
Skyrizi (risanquizumabe) 150mg/mL / Carpule 1,2ml
Skyrizi (risanquizumabe) 150mg/mL / Carpule 2,4ml
Skyrizi (risanquizumabe) 60mg/mL / Frasco 10ml
Classe Terapêutica
Anticorpo monoclonal
Indicação
Psoríase em placas
É indicado para o tratamento de psoríase em placas moderada a grave em pacientes adultos que são candidatos a terapia sistêmica ou fototerapia.
Artrite psoriásica
Em monoterapia ou em combinação com metotrexato (MTX), é indicado para o tratamento da artrite psoriásica ativa em adultos que tiveram uma resposta inadequada ou que foram intolerantes a um ou mais medicamentos antirreumáticos modificadores da doença (DMARDs).
Doença de Crohn
É indicado para o tratamento da doença de Crohn (DC) ativa, moderada a grave em pacientes adultos.
Colite ou retocolite ulcerativa
É indicado para o tratamento da colite ou retocolite ulcerativa (RCU) ativa moderada a grave em pacientes adultos.
Dose
Psoríase em placas e Artrite psoriásica
A dose recomendada é de 150mg, administradas por injeção subcutânea na semana 0, semana 4 e a cada 12 semanas, iniciando após a 2a dose.
Deve-se considerar a descontinuação do tratamento em pacientes que não apresentaram resposta após 16 semanas de tratamento. Alguns pacientes com psoríase em placas com resposta parcial inicial podem melhorar subsequentemente com a continuação do tratamento além de 16 semanas.
Doença de Crohn
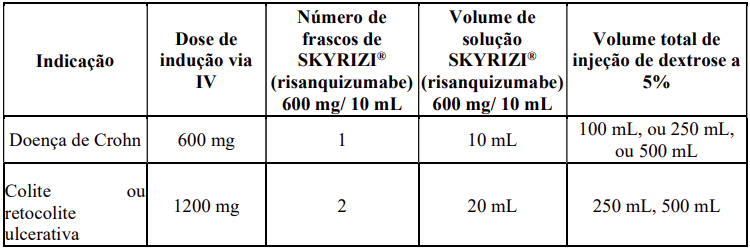
A dose recomendada é de 600mg, administrada por infusão intravenosa (IV) na semana 0, na semana 4 e na semana 8, seguidas de 360mg, administrada por injeção subcutânea (SC) na Semana 12, e a partir de então, a cada 8 semanas.
Alguns pacientes que não responderam ao tratamento na semana 12, podem beneficiar-se da terapia de manutenção continuada por mais 12 semanas. Deve-se considerar a descontinuação do tratamento em pacientes que não demonstraram evidência de benefício terapêutico até a semana 24. Colite ou retocolite ulcerativa
A dose recomendada é de 1200mg, administrada por infusão intravenosa (IV) na semana 0, na semana 4 e na semana 8, seguida de 180mg, administrada por injeção subcutânea (SC) na semana 12 e, a partir de então, a cada 8 semanas.
Dose esquecida
Se uma dose for esquecida, administrar a dose o mais rápido possível. Posteriormente, retomar a administração no dia e horário regular.
Ajuste de dose
Insuficiência renal: Não foram realizados estudos específicos para avaliar o efeito nessa população.
Insuficiência hepática: Não foram realizados estudos específicos para avaliar o efeito nessa população.
Preparo
Instruções para preparação e administração (Doença de Crohn e Colite ou retocolite ulcerativa)
Risanquizumabe 60mg/mL para uso intravenoso na indução do tratamento
Deve ser preparado com técnica asséptica por um profissional de saúde.
Antes da administração intravenosa seguir as instruções abaixo para diluição de risanquizumabe para uma concentração final do fármaco de aproximadamente 1,2mg/mL a 6mg/mL.
Vias de administração
SUBCUTÂNEA E INTRAVENOSA
Administração
Antes do início da infusão intravenosa, o conteúdo da bolsa de infusão ou frasco de vidro deve estar à temperatura ambiente.
Faça a infusão da solução diluída por um período de pelo menos uma hora para dose de 600mg de risanquizumabe e de pelo menos duas horas para 1200mg. A infusão deve ser administrada completamente dentro de 8 horas após a diluição na bolsa de infusão.
Solução injetável não deve ser administrado concomitantemente na mesma linha intravenosa com outros medicamentos.
Cada frasco destina-se a uma única utilização e qualquer medicamento não utilizado ou resíduos devem ser descartados de acordo com as exigências locais.
Cuidados específicos e monitoramento
Rastreabilidade: Com o objetivo de melhorar a rastreabilidade de produtos biológicos, o nome comercial e o lote do medicamento utilizado devem ser devidamente registrados.
Hipersensibilidade: Reações de hipersensibilidade graves, incluindo anafilaxia, foram relatadas. Caso ocorra uma reação de hipersensibilidade grave, descontinue a administração e inicie terapia apropriada imediatamente.
Infecções: Pode aumentar o risco de infecções. Em pacientes com infecção crônica ou histórico de infecção recorrente, os riscos e benefícios devem ser considerados antes de se prescrever risanquizumabe.
Pacientes devem ser instruídos a procurarem seu médico, caso desenvolvam sinais ou sintomas de infecção clinicamente importantes. Se um paciente desenvolver infecção ou não estiver respondendo à terapia padrão para a infecção, o paciente deve ser monitorado cuidadosamente e não deve ser administrado até que a infecção regrida.
Tuberculose: Medicamentos imunossupressores podem ativar focos primários de tuberculose. Esteja alerta quanto à possibilidade de surgimento de doença ativa, tomando os cuidados para o diagnóstico precoce e tratamento.
Imunizações: antes de iniciar a terapia, a conclusão de todas as imunizações apropriadas deve ser considerada de acordo com as diretrizes atuais de imunização. Se um paciente tiver recebido vacinas vivas (viral ou bacteriana), é recomendado aguardar pelo menos 4 semanas antes de iniciar o tratamento com risanquizumabe. Os pacientes tratados com risanquizumabe não devem receber vacinas vivas durante o tratamento e por pelo menos 21 semanas após o tratamento.
Excipientes com efeito conhecido: SKYRIZI® 75mg/0,83mL contém 68,0mg de sorbitol por dose de 150mg. O efeito aditivo de produtos administrados concomitantemente contendo sorbitol (ou frutose) e o consumo alimentar de sorbitol (ou frutose) deve ser levado em consideração. Capacidade de dirigir veículos e operar máquinas: Não tem ou apresenta influência pouco significativa na capacidade de dirigir e utilizar máquinas.
Populações especiais:
Uso na gestação
Categoria B: Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica ou do cirurgião-dentista.
Mulheres em idade fértil: as mulheres com potencial para engravidar devem utilizar um método contraceptivo eficaz durante o tratamento e por pelo menos 21 semanas após a última dose do tratamento.
Uso na lactação: não há dados disponíveis sobre a presença de risanquizumabe no leite humano, sobre os efeitos no bebê amamentado ou sobre os efeitos na produção de leite. Embora a IgG humana seja secretada no leite humano, os dados publicados sugerem que os anticorpos no leite materno não entram na circulação neonatal e infantil em quantidades substanciais.
Uso em idosos: Não foram observadas diferenças na exposição de risanquizumabe entre pacientes idosos e mais jovens.
Pacientes pediátricos: A segurança e eficácia em pacientes pediátricos com menos de 18 anos de idade ainda não foram estabelecidas.
Interações medicamentosas
Não se espera que risanquizumabe seja metabolizado por enzimas hepáticas ou sofra eliminação renal. Não são esperadas interações medicamentosas com inibidores e indutores de enzimas que metabolizam medicamentos. Com base nos resultados de estudos de interações medicamentosas em pacientes com psoríase em placas, doença de Crohn ou RCU, e na análise farmacocinética populacional em psoríase em placas, artrite psoriásica, doença de Crohn e RCU, risanquizumabe não causaria ou seria impactado por interações medicamentosas.
Não é necessário ajuste de dose quando se administra concomitantemente risanquizumabe e substratos do citocromo P450.
Terapia imunossupressora concomitante: a segurança e eficácia em combinação com medicamentos imunossupressores, incluindo produtos biológicos, ou com fototerapia, não foram avaliadas.
Em caso de suspeita de dengue, ou quando associado a outros medicamentos que aumentem o efeito hemorrágico, a prescrição deste medicamento ou a manutenção do tratamento com ele deve ser reavaliada, devido a seu potencial hemorrágico.
Estabilidade/ Conservação
Deve ser mantido em sua embalagem original. Armazenar em geladeira (de 2°C a 8°C). Proteger da luz. Não congelar.
Reações adversas
As reações adversas ao SKYRIZI® (risanquizumabe) provenientes de estudos clínicos estão listadas por classe de sistemas e órgãos do MedDRA e baseiam-se na seguinte convenção: muito comum (≥1/10); comum (≥1/100 a <1/10); incomum (≥1 / 1.000 a <1/100); rara (≥1/10.000 a <1/1.000); e muito rara (<1/10.000).
– Infecções e infestações
Reação muito comum: infecções do trato respiratório superiora
Reação comum: micoses superficiaisb
Reação incomum: foliculite
– Distúrbios do sistema nervoso
Reação comum: cefaleiac
– Distúrbios gerais e condições do local de administração
Reação comum: fadigad e reações no local da injeçãoe
a Inclui: infecção do trato respiratório (viral, bacteriana ou não especificada), sinusite (incluindo aguda), rinite, nasofaringite, faringite (incluindo viral), tonsilite
b Inclui: tinea pedis, tinea cruris, tinea corporis, pitiríase versicolor, tinea manuum, onicomicose
c Inclui: cefaleia, cefaleia tensional, cefaleia sinusal
d Inclui: fadiga, astenia, mal-estar
e Inclui: hematoma no local da injeção, eritema, hematoma, hemorragia, irritação, dor, prurido, reação, edema, eritema no local de infusão, extravasamento no local de infusão, reação no local de infusão, inchaço no local de infusão
Contraindicações
Não deve ser usado em pacientes alérgicos ao risanquizumabe ou a qualquer um dos componentes da formulação e em pacientes com infecções clinicamente ativas importantes.
Fonte
Skyrizi®. [Bula]. São Paulo: AbbVie Farmacêutica Ltda. Disponível em: https://consultas.anvisa.gov.br/#/bulario/q/?numeroRegistro=198600016: 28/08/2025
